
【題目】Fe、Ni均為Ⅷ族元素,與C、N、O、P等組成的化合物有廣泛的用途。回答下列問題:
![]() 基態
基態![]() 的價層電子排布圖
的價層電子排布圖![]() 軌道表達式
軌道表達式![]() 為________,C、N、O的第一電離能從小到大的順序為________
為________,C、N、O的第一電離能從小到大的順序為________
![]() 、P可形成一些復雜離子,如
、P可形成一些復雜離子,如![]() 、
、![]() 、
、![]() 等。
等。
![]() 中N原子的雜化類型為________,
中N原子的雜化類型為________,![]() 的空間構型是為________
的空間構型是為________
![]() 是一種白色固體,在加壓下于
是一種白色固體,在加壓下于![]() 時液化,形成一種能導電的熔體。熔體能導電的原因是________
時液化,形成一種能導電的熔體。熔體能導電的原因是________
![]() 、Ni易與
、Ni易與![]() 與
與![]() 互為等電子體
互為等電子體![]() 形成配合物,
形成配合物,![]() 中
中![]() 鍵與
鍵與![]() 鍵個數比為________,
鍵個數比為________,![]() 熔點
熔點![]() ,沸點
,沸點![]() ,不溶于水,溶于乙醇、苯等有機溶劑,
,不溶于水,溶于乙醇、苯等有機溶劑,![]() 屬于________晶體
屬于________晶體
![]() 、NiO的晶體類型與結構和NaCl相同。
、NiO的晶體類型與結構和NaCl相同。
![]() 熔點FeO________
熔點FeO________![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]()
![]() 晶胞如下圖,
晶胞如下圖,![]() 的配位數為________
的配位數為________

![]() 在氧氣中加熱,部分
在氧氣中加熱,部分![]() 被氧化為
被氧化為![]() ,晶體結構產生鐵離子缺位的缺陷,其組成變為
,晶體結構產生鐵離子缺位的缺陷,其組成變為![]() ,測得晶胞邊長為acm,密度為
,測得晶胞邊長為acm,密度為![]() ,則
,則![]() ________
________
【答案】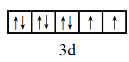
![]()
![]() 直線形 熔體中含有可自由移動的離子
直線形 熔體中含有可自由移動的離子![]() 和
和![]()
![]() 分子
分子 ![]()
![]()
![]() 。
。
【解析】
![]() 基態
基態 ![]() 的價層電子排布式為3d8;隨著核電荷數的遞增,C、N、O的最外層電子數逐漸增多,第一電離能應該逐漸增大,但是N的p軌道電子處于半充滿狀態,較難失去電子;
的價層電子排布式為3d8;隨著核電荷數的遞增,C、N、O的最外層電子數逐漸增多,第一電離能應該逐漸增大,但是N的p軌道電子處于半充滿狀態,較難失去電子;
(2)①![]() 中 N原子形成4個電子對,無孤對電子,而
中 N原子形成4個電子對,無孤對電子,而![]() 中N原子形成2個電子對,無孤對電子;
中N原子形成2個電子對,無孤對電子;
![]() 在加壓下于
在加壓下于 ![]() 時液化,形成一種能導電的熔體,說明存在可自由移動的陰、陽離子,結合P可形成一些復雜離子如
時液化,形成一種能導電的熔體,說明存在可自由移動的陰、陽離子,結合P可形成一些復雜離子如![]() 分析;
分析;
![]() 結構式為
結構式為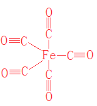 ,其中CO中含有碳氧叁鍵;
,其中CO中含有碳氧叁鍵;
(4)①比較Fe2+和Ni2+的半徑,根據晶格能分析;
![]() 的晶體結構類型與氯化鈉相同,氯化鈉中鈉離子和氯離子配位數都是6;
的晶體結構類型與氯化鈉相同,氯化鈉中鈉離子和氯離子配位數都是6;
![]() 晶胞中含有4個Fe原子和4個O原子,因此部分
晶胞中含有4個Fe原子和4個O原子,因此部分![]() 被氧化為
被氧化為![]() 后變為
后變為 ![]() 時含有4個O原子和4x個 Fe原子,再結合
時含有4個O原子和4x個 Fe原子,再結合![]() 計算即可。
計算即可。
![]() 基態
基態 ![]() 的價層電子排布式為3d8,因此價層電子排布的軌道表示式為
的價層電子排布式為3d8,因此價層電子排布的軌道表示式為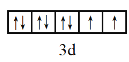 ;隨著核電荷數的遞增,C、N、O的最外層電子數逐漸增多,第一電離能應該逐漸增大,但是N的p軌道電子處于半充滿狀態,較難失去電子,因此 N的第一電離能比O大,第一電離能從小到大的順序為
;隨著核電荷數的遞增,C、N、O的最外層電子數逐漸增多,第一電離能應該逐漸增大,但是N的p軌道電子處于半充滿狀態,較難失去電子,因此 N的第一電離能比O大,第一電離能從小到大的順序為 ![]() ;
;
![]() 根據價層電子對互斥理論,
根據價層電子對互斥理論,![]() 中 N原子的雜化類型為
中 N原子的雜化類型為![]() ,
,![]() 的雜化類型為 sp,因此
的雜化類型為 sp,因此![]() 的空間構型是直線形;
的空間構型是直線形;
![]() 在加壓下于
在加壓下于 ![]() 時液化,形成一種能導電的熔體,在題干條件中可知 P可形成一些復雜離子如
時液化,形成一種能導電的熔體,在題干條件中可知 P可形成一些復雜離子如![]() ,因此
,因此![]() 熔體中含有可自由移動的離子
熔體中含有可自由移動的離子![]() 和
和![]() ;
;
![]() 結構式為
結構式為 ,因此
,因此 ![]() 中
中![]() 鍵的個數為
鍵的個數為 ![]() 個加上碳氧三鍵中的5個共10個,
個加上碳氧三鍵中的5個共10個,![]() 鍵個數為碳氧三鍵中10個,因此
鍵個數為碳氧三鍵中10個,因此 ![]() 中
中![]() 鍵與
鍵與![]() 鍵個數比為
鍵個數比為![]() ;
;![]() 熔沸點低,屬于分子晶體;
熔沸點低,屬于分子晶體;
![]() 的半徑大于
的半徑大于![]() 的半徑,FeO的晶格能小,則熔點
的半徑,FeO的晶格能小,則熔點![]() ;
;
![]() 的晶體結構類型與氯化鈉相同,氯化鈉中鈉離子和氯離子配位數都是6,據此判斷FeO晶胞中
的晶體結構類型與氯化鈉相同,氯化鈉中鈉離子和氯離子配位數都是6,據此判斷FeO晶胞中![]() 的配位數為6;
的配位數為6;
![]() 晶胞中含有4個Fe原子和4個O原子,因此部分
晶胞中含有4個Fe原子和4個O原子,因此部分![]() 被氧化為
被氧化為![]() 后變為
后變為 ![]() 時含有4個O原子和4x個 Fe原子,根據題目提供數據可得列出晶胞密度是方程式為
時含有4個O原子和4x個 Fe原子,根據題目提供數據可得列出晶胞密度是方程式為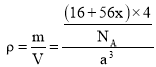 ,解得
,解得![]() 。
。


科目:高中化學 來源: 題型:
【題目】下列事實可以用勒夏特列原理解釋的是
A. 高錳酸鉀溶液與草酸發生化學反應剛開始緩慢,隨后反應迅速加快
B. 實驗室采用排飽和食鹽水的方法收集氯氣(Cl2+H2O![]() HCl+HClO)
HCl+HClO)
C. 500 ℃左右的溫度比室溫更有利于合成氮反應N2(g)+ 3H2 (g)![]() 2NH3(g) △H<0
2NH3(g) △H<0
D. FeCl3+3KSCN![]() Fe(SCN)3+3KCl, 增大KCl的濃度則溶液的顏色變淺
Fe(SCN)3+3KCl, 增大KCl的濃度則溶液的顏色變淺
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列化學實驗示意圖及表中實驗現象,從理論上分析得出的結論正確的是

選項 | 實驗 | 實驗現象 | 結論 |
A | a | 左燒杯中鐵表面有氣泡,右燒杯中銅表面有氣泡 | 活動性:Al>Fe>Cu |
B | b | 左邊棉花變為橙色,右邊棉花變為藍色 | 氧化性:Cl2>Br2>I2 |
C | c | 白色固體先變為淡黃色,后變為黑色 | 溶解度:AgCl < AgBr < Ag2S |
D | d | 錐形瓶中有氣體產生,燒杯中液體變渾濁 | 非金屬性:Cl>C>Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1,3-二異丙烯基苯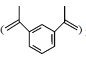 是重要的化工原料,下列說法正確的是( )
是重要的化工原料,下列說法正確的是( )
A.不可發生加聚反應B.不能使稀的高錳酸鉀溶液褪色
C.分子中所有原子共平面D.其苯環上二氯代物有4種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是中學化學中常用于混合物的分離和提純的裝置,請根據裝置回答問題:

(1)在裝置A和裝置B中都用到玻璃棒,裝置A中玻璃棒的作用是__,裝置B中玻璃棒的作用是__,防止蒸發皿內溶液因局部過熱而濺出。
(2)裝置C中①的名稱是__,①中加入沸石的作用是__,冷卻水的方向是__。
(3)從氯化鈉溶液中得到氯化鈉固體,選擇裝置__(填代表裝置圖的字母,下同);除去自來水中的Cl等雜質,選擇裝置__。檢驗自來水中Cl-是否除凈的方法:取少量錐形瓶中的水于潔凈試管中,滴加__,不產生白色沉淀表明Cl已除凈。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組以黃銅礦(主要成分CuFeS2)為原料進行如下實驗探究.為測定黃銅礦中硫元素的質量分數,將m1 g該黃銅礦樣品放入如圖所示裝置中,從a處不斷地緩緩通入空氣,高溫灼燒石英管中的黃銅礦樣品.

(1)錐形瓶A內所盛試劑是_________;裝置B的作用是_________;錐形瓶D內發生反應的離子方程式為:_______________________。
(2)反應結束后將錐形瓶D中的溶液進行如下處理:

如圖向錐形瓶D中加入過量H2O2溶液反應的離子方程式為_________;操作Ⅱ是洗滌、烘干、稱重,其中洗滌的具體方法________;該黃銅礦中硫元素的質量分數為_________(用含m1、m2的代數式表示)。
(3)反應后固體經熔煉、煅燒后得到泡銅(Cu、Cu2O)和熔渣(Fe2O3、FeO),要驗證熔渣中存在FeO,應選用的最佳試劑是__________。
A.KSCN溶液、氯水
B.稀鹽酸、KMnO4溶液
C.稀硫酸、KMnO4溶液
D.NaOH溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國科學院研究員馬大為以氨基酸銅的絡合物為催化劑實現了碳![]() 氮鍵的高效構筑,為含苯胺片段的藥物及材料的合成提供了一種簡便、實用的方法,馬大為借助這一研究也獲得了“未來科學大獎物質科學獎”。如圖是一種氨基酸銅的絡合物的結構簡式。
氮鍵的高效構筑,為含苯胺片段的藥物及材料的合成提供了一種簡便、實用的方法,馬大為借助這一研究也獲得了“未來科學大獎物質科學獎”。如圖是一種氨基酸銅的絡合物的結構簡式。
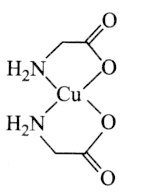
回答下列問題:
![]() 基態銅原子的最外層電子所處的原子軌道的形狀為________,某同學查閱資料發現銅有
基態銅原子的最外層電子所處的原子軌道的形狀為________,某同學查閱資料發現銅有![]() 價,則基態
價,則基態![]() 的價電子軌道表達式為________。
的價電子軌道表達式為________。
![]() 、C、N、O四種元素的第一電離能由大到小的順序為________
、C、N、O四種元素的第一電離能由大到小的順序為________![]() 用元素符號表示
用元素符號表示![]() ;該氨基酸銅中碳原子的雜化方式為________;
;該氨基酸銅中碳原子的雜化方式為________;![]() 氨基酸銅中含有________
氨基酸銅中含有________![]() 鍵。
鍵。
![]() 、O元素可形成多種微粒,
、O元素可形成多種微粒,![]() 的空間構型為________,寫出一種與
的空間構型為________,寫出一種與![]() 互為等電子體的分子的化學式:________。
互為等電子體的分子的化學式:________。
![]() 銅晶體是面心立方結構,銅晶體的空間利用率為________;配位數為________。
銅晶體是面心立方結構,銅晶體的空間利用率為________;配位數為________。
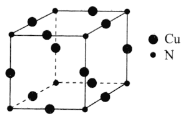
![]() 銅元素與氮元素形成的一種晶體的立方晶胞如圖所示,該晶體的化學式為________,兩個最近的氮原子之間的距離為anm,
銅元素與氮元素形成的一種晶體的立方晶胞如圖所示,該晶體的化學式為________,兩個最近的氮原子之間的距離為anm,![]() 表示阿伏加德羅常數的值,則該晶體的密度為________
表示阿伏加德羅常數的值,則該晶體的密度為________![]() 用含a、
用含a、![]() 的代數式表示
的代數式表示![]() 。
。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在![]() 的反應中,下列說法不正確的是
的反應中,下列說法不正確的是![]()
![]()
A.![]() 既是氧化劑,又是還原劑
既是氧化劑,又是還原劑
B.KCl是還原產物,![]() 是氧化產物
是氧化產物
C.反應中每消耗![]() ,轉移電子數為
,轉移電子數為![]()
D.該氧化還原反應中只有氯元素化合價發生了改變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化氯是高效、低毒的消毒劑。已知:ClO2是一種黃綠色易溶于水的氣體,具有強氧化性,回答下列問題:
(1)ClO2的制備及性質探究裝置如圖:

①儀器a的名稱為___,裝置B的作用是___。
②裝置C用于制備ClO2,同時還生成一種酸式鹽,該反應的化學方程式為___。裝置D的作用是___。
③ClO2可用于處理堿性含硫廢水(硫被氧化為最高價態),ClO2與Na2S溶液反應的離子方程式為___。
④裝置E用于吸收尾氣,反應可得NaClO2溶液。已知NaClO2飽和溶液在溫度低于38 ℃時析出的晶體是NaClO23H2O,在溫度高于38℃時析出的晶體是NaClO2。請補充從NaClO2溶液中制得NaClO2晶體的操作步驟:
ⅰ.___;
ⅱ.___;
ⅲ.洗滌;
ⅳ.干燥。
(2)測定生成ClO2的質量
實驗步驟如下:
a.取下裝置D,將其中的溶液轉入250mL容量瓶,用蒸餾水洗滌裝置D2~3次,并將洗滌液一并轉移到容量瓶中,加蒸餾水稀釋至刻度。
b.從容量瓶中取出25.00mL溶液于錐形瓶中,用0.1000molL-1硫代硫酸鈉標準溶液滴定(2Na2S2O3+I2=Na2S4O6+2NaI),指示劑顯示終點時消耗硫代硫酸鈉溶液24.00mL。
①滴定至終點的現象是___。
②進入裝置D中的ClO2的質量為___。
③若滴定開始仰視讀數,滴定終點時正確讀數,則測定結果___(填偏高偏低或不變)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com