


科目:高中化學 來源: 題型:閱讀理解
 甲、乙兩位同學設計用實驗確定某酸HA是弱電解質,存在電離平衡,且改變條件平衡發生移動.實驗方案如下:
甲、乙兩位同學設計用實驗確定某酸HA是弱電解質,存在電離平衡,且改變條件平衡發生移動.實驗方案如下:| 1 | 25 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
(8分)甲、乙兩位同學設計用實驗確定某酸HA是弱電解質,存在電離平衡,且改變條件平衡發生移動。實驗方案如下:
甲:①準確配制0.1mol·L-1的HA、HCl溶液各100mL;
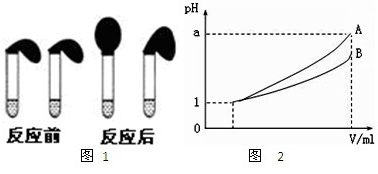
②取純度相同,質量、大小相等的鋅粒放入兩只試管中,同時加入0.1mol·L-1的HA、HCl溶液各100mL,按上圖裝好,觀察現象。
乙:①用pH計測定物質的量濃度均為0.1mol·L-1的HA和HCl溶液的pH;
②再取0.1mol·L-1的HA和HCl溶液各2滴(1滴約為![]() )分別稀釋至100mL,
)分別稀釋至100mL,
再用pH計測其pH變化。
(1)乙方案中說明HA是弱電解質的理由是,測得0.1mol·L-1的HA溶液的pH 1(填“>”“<”或“=”);甲方案中,說明HA是弱電解質的實驗現象是 。
A.裝HCl的試管中放出的氫氣速率大
B.裝HA溶液的試管中放出氫氣的速率大
C.兩個試管中產生氣體速率一樣大
(2)乙同學設計的實驗第②步,能證明改變條件解質平衡發生移動。加水稀釋,弱酸HA的電離程度 (填“增大、減小、不變”)
(3)甲同學為了進一步證明弱電解質電離平衡移動的情況,設計如下實驗:使HA的電離程度和c(H+)都減小,c(A)增大,可在0.1mol·L-1的HA溶液中,選擇加入 試劑。
A.NaA固體(可完全溶于水) B.1mol·L-1NaOH溶液
C.1mol·L-1H2SO4 D.2mol·L-1HA
(4)pH=1的兩種酸溶液A、B各1mL,分別加水稀釋到1000mL,其pH與溶液體積V的關系如右圖所示,則下列說法不正確的有
A.若a=4,則A是強酸,B是弱酸
B.若![]() ,則A、B都是弱酸
,則A、B都是弱酸
C.兩種酸溶液的物質的量嘗試一定相等
D.稀釋后,A溶液的酸性比B溶液弱
查看答案和解析>>
科目:高中化學 來源:2010年北京市高三上學期起點考試化學試題 題型:實驗題
(8分)甲、乙兩位同學設計用實驗確定某酸HA是弱電解質,存在電離平衡,且改變條件平衡發生移動。實驗方案如下:
甲:①準確配制0.1mol·L-1的HA、HC l溶液各100mL;
l溶液各100mL;
②取純度相同,質量、大小相等的鋅粒放入兩只試管中,同時加入0.1mol·L-1的HA、HCl溶液各100mL,按上圖裝好,觀察現象。
乙:①用pH計測定物質的量濃度均為0.1mol·L-1的HA和HCl溶液的pH;
②再取0.1mol·L-1的HA和HCl溶液各2滴(1滴約為 )分別稀釋至100mL,
)分別稀釋至100mL,
再用pH計測其pH變化。
(1)乙方案中說明HA是弱電解質的理由是,測得0.1mol·L-1的HA溶液的pH 1(填“>”“<”或“=”);甲方案中,說明HA是弱電解質的實驗現象是 。
A.裝HCl的試管中放出的氫氣速率大
B.裝HA溶液的試管中放出氫氣的速率大
C.兩個試管中產生氣體速率一樣大
(2)乙同學設計的實驗第②步,能證明改變條件解質平衡發生移動。加水稀釋,弱酸HA的電離程度 (填“增大、減小、不變”)
(3)甲同學為了進一步證明弱電解質電離平衡移動的情況,設計如下實驗:使HA的電離程度和c(H+)都減小,c(A)增大,可在0.1mol·L-1的HA溶液中,選擇加入 試劑。
A.NaA固體(可完全溶于水) B.1mol·L-1NaOH溶液
C.1mol ·L-1H2SO4 D.2mol·L-1HA
·L-1H2SO4 D.2mol·L-1HA
(4)pH=1的兩種酸溶液A、B各1mL,分別加水稀釋到1000mL ,其pH與溶液體積V的關系如右圖所示,則下列說法不正確的有
,其pH與溶液體積V的關系如右圖所示,則下列說法不正確的有 
A.若a=4,則A是強酸,B是弱酸
B.若 ,則A、B都是弱酸
,則A、B都是弱酸
C.兩種酸溶液的物質的量嘗試一定相等
D.稀釋后,A溶液的酸性比B溶液弱
查看答案和解析>>
科目:高中化學 來源:2010年湖北省襄樊市四校聯考-高二上學期期中考試化學卷 題型:填空題
甲、乙兩位同學設計用實驗確定某酸HA是弱電解質,存在電離平衡,且改變條件平衡發生移動。實驗方案如下:
甲:取純度相同,質量、大小相等的鋅粒于兩只試管中,同時加入0.1 mol·L-1的 HA、HCl溶液各10 mL,按圖裝好,觀察現象;
乙:① 用pH計測定物質的量濃度均為0.1 mol·L-1 HA和HCl溶液的pH;
② 再取0.1 mol·L-1的HA和HCl溶液各2滴(1滴約為1/25 mL)分別稀釋至100 mL,再用pH計測其pH變化
(1)乙方案中說明HA是弱電解質的理由是:測得0.1 mol·L-1的HA溶液的pH 1(填“>”、“<”或“=”) ;甲方案中,說明HA是弱電解質的實驗現象是:
A.加入HCl溶液后,試管上方的氣球鼓起快
B.加入HA溶液后, 試管上方的氣球鼓起慢
C.加入兩種稀酸后,兩個試管上方的氣球同時鼓起,且一樣大
(2)乙同學設計的實驗第______步,能證明改變條件弱電解質平衡發生移動。甲同學為了進一步證明弱電解質電離平衡移動的情況,設計如下實驗:①使HA的電離程度和c(H+)都減小, c(A-)增大,可在0.1 mol·L-1的HA溶液中,選擇加入_________試劑(選填“A”“B”“C”“D”,下同);②使HA的電離程度減小,c(H+)和c(A-)都增大,可在0.1 mol·L-1的HA溶液中,選擇加入_____試劑。
A. NaA固體(可完全溶于水)
B.1 mol·L-1 NaOH溶液
C. 1 mol·L-1 H2SO4 D.2 mol·L-1 HA
(3)pH=1的兩種酸溶液A、B各1 mL,分別加水稀釋到1000 mL,其pH與溶液體積V的關系如圖所示,則下列說法不正確的有 
A.兩種酸溶液的物質的量濃度一定相等
B.稀釋后,A酸溶液的酸性比B酸溶液弱
C.若a=4,則A是強酸,B是弱酸
D.若1<a<4,則A、B都是弱酸
E.稀釋后A溶液中水的電離程度比B溶液中水的電離程度小
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com