
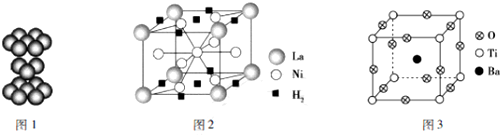
分析 (1)Ni原子核外電子數為28,根據能量最低原理書寫核外電子排布式;
(2)由鈦晶體的原子堆積方式可知,屬于六方最密堆積;
(3)根據均攤法計算晶胞中La、Ni原子數目,進而確定化學式;計算晶胞中氫氣分子數目,結合晶胞中La與氫氣分子數目之比計算1mol鑭形成的該合金能儲存氫氣物質的量;
(4)①該晶體中的O元素與H形成的簡單化合物為H2O,O原子形成2個O-H鍵,含有2對孤對電子;
②原子的得電子能力越強,其電負性的數值越大;同一周期元素,元素的第一電離能隨著原子序數增大而增大,但第IIA族、第VA族元素第一電離能大于其相鄰元素,據此判斷第一電離能大小順序;
③根據均攤法計算晶胞中O、Ti、Ba原子數目,進而確定化學式;
④結合晶胞含有原子數目計算晶胞質量,再根據V=$\frac{m}{ρ}$計算晶胞體積,晶胞邊長=$\root{3}{{V}_{晶胞}}$.
解答 解:(1)Ni原子核外電子數為28,根據能量最低原理,核外電子排布式為:1s22s22p63s23p63d84s2,
故答案為:1s22s22p63s23p63d84s2;
(2)由鈦晶體的原子堆積方式可知,屬于六方最密堆積,原子配位數為12,即每個鈦原子周圍有12個緊鄰的鈦原子,
故答案為:12;
(3)算晶胞中La原子數目為8×$\frac{1}{8}$=1、Ni原子數目=1+8×$\frac{1}{2}$=5,故合金的化學式為LaNi5,晶胞中氫氣分子數目為2×$\frac{1}{2}$+8×$\frac{1}{4}$=3,1mol鑭形成的該合金能儲存氫氣物質的量為3mol,
故答案為:LaNi5;3;
(4)①該晶體中的O元素與H形成的簡單化合物為H2O,O原子形成2個O-H鍵,含有2對孤對電子,氧原子采取sp3雜化,空間構型為V形,
故答案為:sp3;V形;
②元素原子的得電子能力越強,則電負性越大,所以F>O>N>C;
同一周期元素,元素的第一電離能隨著原子序數增大而增大,但第IIA族、第VA族元素第一電離能大于其相鄰元素,C、N、O元素處于同一周期且原子序數逐漸增大,N處于第VA族,所以第一電離能F>N>O>C,故答案為:F>N>O; N<O<F;
③晶胞中O氧原子數目為12×$\frac{1}{4}$=3、Ti原子數目為8×$\frac{1}{8}$=1、Ba原子數目1,故化學式為:BaTiO3,
故答案為:BaTiO3;
④晶胞質量=$\frac{137+48+16×3}{{N}_{A}}$g,晶體的密度為ρg/cm3,則晶胞邊長=$\root{3}{\frac{\frac{233}{{N}_{A}}g}{ρg•c{m}^{-3}}}$=$\root{3}{\frac{233}{ρ{N}_{A}}}$cm,
故答案為:$\root{3}{\frac{233}{ρ{N}_{A}}}$.
點評 本題是對物質結構與性質的考查,涉及核外電子排布、雜化方式與空間構型判斷、晶胞結構與計算等,注意理解金屬晶體的堆積方式,對學生的空間想象有一定的要求,難度中等.


 同步練習強化拓展系列答案
同步練習強化拓展系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 石油的分餾、煤的干餾都是物理變化 | |
| B. | 化學反應的限度是不可改變的 | |
| C. | 可用乙醇萃取溴水中的溴 | |
| D. | 在過渡元素中尋找催化劑和耐高溫、耐腐蝕的合金材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 聚乙烯塑料的老化是由于發生了加成反應 | |
| B. | 乙酸乙酯在堿性條件下的水解反應稱為皂化反應 | |
| C. | 葡萄糖注射液不能產生丁達爾效應現象,不屬于膠體 | |
| D. | 棉、麻、合成纖維完全燃燒都只生成CO2和H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:推斷題
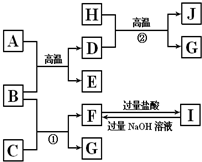 圖中A~J均代表無機物或其水溶液,其中B、D、G是單質,B是地殼中含量最高的金屬元素,G是氣體,J是磁性材料.
圖中A~J均代表無機物或其水溶液,其中B、D、G是單質,B是地殼中含量最高的金屬元素,G是氣體,J是磁性材料.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 工業上“固定”和利用CO2能有效地減輕“溫室”效應,可用CO2生產燃料甲醇:
工業上“固定”和利用CO2能有效地減輕“溫室”效應,可用CO2生產燃料甲醇:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖為實驗室某濃鹽酸試劑瓶標簽上的有關數據,試根據標簽上的有關數據回答下列問題:
如圖為實驗室某濃鹽酸試劑瓶標簽上的有關數據,試根據標簽上的有關數據回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Al2(SO4)3溶液滴加氨水產生白色膠狀沉淀:Al3++3OH-=Al(OH)3↓ | |
| B. | 純堿溶液使酚酞變紅:CO32-+2H2O?H2CO3+2OH- | |
| C. | 乙酸清除水垢后的化學反應原理:2H++CO32-=CO2↑+H2O | |
| D. | FeCl3溶液中加入足量鐵粉,溶液由黃色變成淺綠色:2Fe3++Fe=3Fe2+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com