
| 物質 | X | Y | Z |
| 初始濃度/mol•L-1 | 0.1 | 0.2 | 0 |
| 2 min末濃度/mol•L-1 | 0.08 | a | b |
| 平衡濃度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 平衡時,X 的轉化率為20% | |
| B. | t℃時,該反應的平衡常數為40 | |
| C. | 增大平衡后的體系壓強,v正增大,v逆減小,平衡向正反應方向移動 | |
| D. | 前2 min 內,用Y 的變化量表示的平均反應速率v(Y)=0.03 mol•L-1•min-1 |
分析 A.平衡時X的濃度變化量為(0.1-0.05)mol/L=0.05mol/L,X轉化率=$\frac{X濃度變化量}{X起始濃度}$×100%;
B.平衡常數表達式K=$\frac{{c}^{2}(Z)}{c(X)×{c}^{3}(Y)}$,代入平衡濃度計算;
C.增大壓強,正逆反應速率都增大;
D.根據v=$\frac{△c}{△t}$計算v(X),再利用速率之比等于化學計量數之比計算v(Y).
解答 解:A.平衡時X的濃度變化量為(0.1-0.05)mol/L=0.05mol/L,X的轉化率=$\frac{0.05mol/L}{0.1mol/L}$×100%=50%,故A錯誤;
B.平衡時X、Y均為0.05mol/L,Z為0.1mol/L,則平衡常數K=$\frac{{c}^{2}(Z)}{c(X)×{c}^{3}(Y)}$=$\frac{0.{1}^{2}}{0.05×0.0{5}^{3}}$=1600,故B錯誤;
C.增大壓強,正逆反應速率都增大,正反應是氣體體積減小的反應,增大壓強平衡正向移動,正反應速率增大更多,故C錯誤;
D.前2 min內,v(X)=$\frac{(0.1-0.08)mol/L}{2min}$=0.01mol•L-1•min-1,速率之比等于化學計量數之比,則v(Y)=3v(X)=0.03mol•L-1•min-1,故D正確.故選D.
點評 本題考查較為綜合,為高考常見題型,側重于學生的分析能力和計算能力的考查,題目涉及合成平衡影響因素分析,平衡計算應用,轉化率、平衡常數概念的分析計算應用,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 無色溶液中可能大量存在Cu2+、K+、Cl?、NO3- | |
| B. | 酸性溶液中可能大量存在Na+、HCO3-、SO42?、I? | |
| C. | 堿性溶液中可能大量存在Na+、K+、Cl?、HCO3? | |
| D. | 中性溶液中可能大量存在Na+、K+、Cl?、SO42? |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖所示,圖Ⅰ是恒壓密閉容器,圖Ⅱ是恒容密閉容器.當其它條件相同時,在Ⅰ、Ⅱ中都分別加入2molX和2molY,開始時容器的體積均為VL,發生如下反應并達到平衡狀態:2X(?)+Y(?)?aZ(g).此時Ⅰ中X、Y、Z的物質的量之比為1:3:2.下列判斷不正確的是( )
如圖所示,圖Ⅰ是恒壓密閉容器,圖Ⅱ是恒容密閉容器.當其它條件相同時,在Ⅰ、Ⅱ中都分別加入2molX和2molY,開始時容器的體積均為VL,發生如下反應并達到平衡狀態:2X(?)+Y(?)?aZ(g).此時Ⅰ中X、Y、Z的物質的量之比為1:3:2.下列判斷不正確的是( )| A. | 物質Z的化學計量數a=1 | |
| B. | 若X、Y均為氣態,則在平衡時X的轉化率:Ⅰ>Ⅱ | |
| C. | 若Ⅱ中氣體的密度變化如圖Ⅲ所示,則X、Y中只有一種為氣態 | |
| D. | 若X為固態、Y為氣態,則Ⅰ、Ⅱ中從開始到平衡所需的時間:Ⅰ>Ⅱ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| H2CO3 | H2SO3 | HNO2 | HClO |
| K1=4.4×10-7 K2=4.7×10-11 | K1=1.2×10-2 K2=6.6×10-8 | K=7.2×10-4 | K=2.9×10-8 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
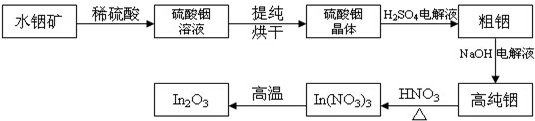
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
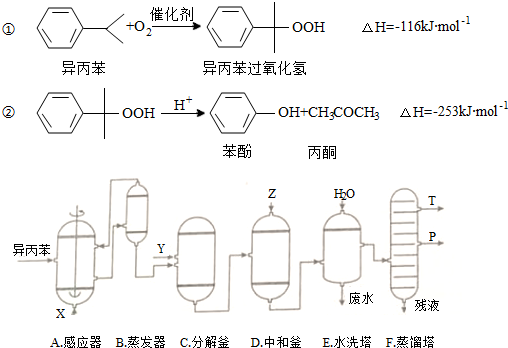
| 物質 | 相對分子質量 | 密度(g/cm-3) | 沸點/℃ |
| 異丙苯 | 120 | 0.8640 | 153 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 苯酚 | 94 | 1.0722 | 182 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

| 密度(g•cm-3) | 熔點(℃) | 沸點(℃) | 溶解性 | |
| 環己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 環己烯 | 0.81 | -103 | 83 | 難溶于水 |
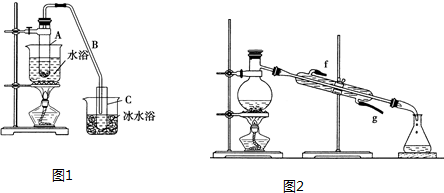
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaHSO3溶液與NaOH溶液反應:HSO3-+OH-═SO32-+H2O | |
| B. | 少量二氧化碳通入足量的NaOH溶液:CO2+2OH-═CO32-+H2O | |
| C. | Ba(OH)2與H2SO4反應:H++OH-═H2O | |
| D. | 氨水和醋酸溶液混合:NH3•H2O+CH3COOH═NH4++CH3COO-+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com