
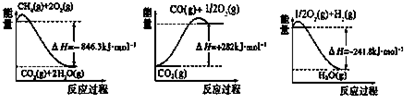
分析 (1)由圖可得熱化學方程式:①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3KJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-282KJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol
根據蓋斯定律,①-③×3-②得到:CH4(g)+H2O(g)=CO(g)+3H2 (g);
(2)吸收CO后的乙酸銅氨液經過適當處理后又可再生,用使平衡逆向移動,正反應為氣體體積減小的放熱反應,在高溫、低壓下有利于平均逆向進行;
(3)某溫度下,向容積為100L的密閉容器中通入4molNH3和2molCO2,該反應進行到40s時達到平衡,此時CO2的轉化率為50%,轉化的二氧化碳為1mol,則:
2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)
起始量(mol):4 2 0
變化量(mol):2 1 1
平衡量(mol):2 1 1
再根據K=$\frac{c({H}_{2}O)}{{c}^{2}(N{H}_{3})×c(C{O}_{2})}$計算平衡常數.
解答 解:(1)由圖可得熱化學方程式:①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-846.3KJ/mol
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-282KJ/mol
③H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol
根據蓋斯定律,①-③×3-②得到:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1,
故答案為:CH4(g)+H2O(g)=CO(g)+3H2 (g)△H=+161.1kJ•mol-1;
(2)吸收CO后的乙酸銅氨液經過適當處理后又可再生,用使平衡逆向移動,正反應為氣體體積減小的放熱反應,在高溫、低壓下有利于平均逆向進行,
故選:B;
(3)某溫度下,向容積為100L的密閉容器中通入4molNH3和2molCO2,該反應進行到40s時達到平衡,此時CO2的轉化率為50%,轉化的二氧化碳為1mol,則:
2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)
起始量(mol):4 2 0
變化量(mol):2 1 1
平衡量(mol):2 1 1
則平衡常數K=$\frac{c({H}_{2}O)}{{c}^{2}(N{H}_{3})×c(C{O}_{2})}$=$\frac{\frac{1}{100}}{(\frac{2}{100})^{2}×\frac{1}{100}}$=2500L2•mol-2,
故答案為:2500.
點評 本題考查較為綜合,為高考常見題型和高頻考點,題目涉及熱化學方程式書寫、化學平衡影響因素、平衡常數、離子濃度比較等,是對學生綜合能力的考查.


 應用題作業本系列答案
應用題作業本系列答案科目:高中化學 來源: 題型:選擇題
| A. | 480mL | B. | 1000mL | C. | 100mL | D. | 500mL |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
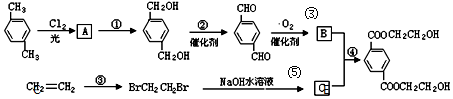
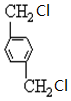 、B、
、B、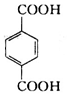 、C.HOCH2CH2OH、
、C.HOCH2CH2OH、 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$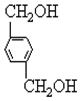 +2NaCl;
+2NaCl; ,反應的化學方程式是
,反應的化學方程式是 +4[Ag(NH3)2]OH$\stackrel{△}{→}$4Ag↓+6NH3↑+
+4[Ag(NH3)2]OH$\stackrel{△}{→}$4Ag↓+6NH3↑+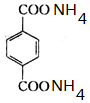 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2CO3?2H++CO32- | B. | Ba(OH)2?Ba2++2OH- | ||
| C. | NaHCO3?Na++HCO3- | D. | HClO?H++ClO- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cu2S的摩爾質量為160 | |
| B. | 每生產1molCu需轉移2mol電子 | |
| C. | 該反應中Cu2S既是氧化劑又是還原劑 | |
| D. | 若用該反應生產銅,全世界每年產生的SO2的體積為1.4×106L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 物質 | CH3OH | CH3OCH3 | H2O |
| c(mol•L-1) | 0.46 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 高錳酸鉀充分加熱后的剩余固體、碘酒、空氣都是混合物 | |
| B. | Na2O和NH3的水溶液均能導電,故均為電解質 | |
| C. | 氧化還原反應中非金屬單質只作氧化劑 | |
| D. | 酸堿中和反應的實質是H+與OH-結合生成水,故酸堿中和反應都可用H++OH-═H2O表示 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | Fe3O4+4CO$\frac{\underline{\;高溫\;}}{\;}$3Fe+4CO2↑ | ||
| C. | Fe+CuSO4═FeSO4+Cu | D. | 2NaCl(熔融)$\frac{\underline{\;通電\;}}{\;}$2Na+Cl2↑ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com