
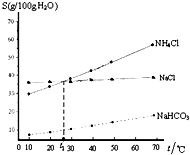
 如圖是NaCl、NH4Cl和NaHCO3的溶解度曲線,下列說法不正確的是( )
如圖是NaCl、NH4Cl和NaHCO3的溶解度曲線,下列說法不正確的是( )

科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
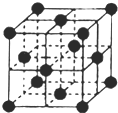 (2013?濟寧二模)已知尿素的結構式為:
(2013?濟寧二模)已知尿素的結構式為: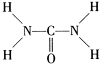 尿素可用于制有機鐵肥,主要代表物有三硝酸六尿素合鐵(Ⅲ),化學式為[Fe(H2NCONH2)6](NO3)3.
尿素可用于制有機鐵肥,主要代表物有三硝酸六尿素合鐵(Ⅲ),化學式為[Fe(H2NCONH2)6](NO3)3.| 234 |
| ρNA |
| 234 |
| ρNA |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| 10-7b |
| a-b |
| 10-7b |
| a-b |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
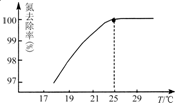 氮可以形成多種化合物,如NH3、N2H4、HCN、NH4NO3等.
氮可以形成多種化合物,如NH3、N2H4、HCN、NH4NO3等.- 4 |
- 4 |
2- 4 |
2- 8 |
2- 8 |
+ 4 |
+ 4 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com