
【題目】物質之間的變化體現了化學之美。
(1)一定條件下,含氮元素的物質可發生如圖所示的循環轉化。
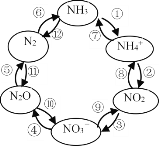
Ⅰ.圖中屬于“氮的固定”的是_______(填序號,下同);轉化過程中發生非氧化還原反應的是_______________。
Ⅱ.反應④是在酸性條件下由NO3-與鎂作用實現,則該反應的離子方程式為_______。
(2)H2S氣體與CuCl2、FeCl3溶液發生一系列反應如圖所示:
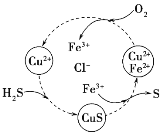
①轉化圖中化合價不變的元素是__________(寫名稱)。
②轉化圖中生成S單質的離子方程式為____________。
(3)A、B、C、D、E、F、X是中學常見的無機物,存在如圖轉化關系(部分生成物和反應條件略去)。
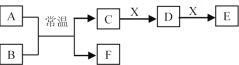
①若A為常見的金屬單質,焰色反應呈黃色,B常溫下為液態,X能使品紅溶液褪色,則C和E反應的離子方程式為________。
②若D為兩性氫氧化物,F為非金屬單質,則X成分可能為____(寫化學式,下同)。
③若A為紅棕色氣體,X為金屬單質,溶液D中加入KSCN溶液變紅。則E為______,F為______。
【答案】⑥和 ①和⑦ 4Mg+2NO3-+10H+=4Mg2++N2O↑+5H2O 銅、氫、氯 CuS+2Fe3+=2Fe2++Cu2++S↓ OH-+HSO3-=SO32-+H2O HCl或NaOH Fe(NO3)2 NO
【解析】
(1)I.將游離態的氮(即氮氣)轉化為化合態的氮(即氮的化合物)的過程,叫做氮的固定,圖中屬于“氮的固定”的是⑥和;非氧化還原反應是指變化過程中元素化合價不變的反應,轉化過程中發生非氧化還原反應的是:①和⑦;
Ⅱ.反應④是在酸性條件下由NO3-與鎂作用實現,反應生成Mg2+、N2O、H2O,離子方程式為:4Mg+2NO3-+10H+=4Mg2++N2O↑+5H2O;
(2)①H2S與Cu2+反應得到CuS與H+,Fe3+將CuS氧化得到S、Cu2+,Fe3+被還原變為Fe2+,O2將Fe2+氧化鐵為Fe3+,圖中O、Fe、S化合價發生變化,而Cu、H、Cl的化合價不變,所以轉化關系圖中未發生價態變化的元素為銅、氫、氯;
②轉化圖中,Fe3+將CuS氧化得到S、Cu2+,Fe3+被還原變為Fe2+,反應的離子方程式為:CuS+2Fe3+=2Fe2++Cu2++S↓;
(3)①若A為常見的金屬單質,焰色反應呈黃色,則A為Na,B為H2O,X能使品紅溶液褪色,且能與C連續反應,C為NaOH、X為SO2、D為Na2SO3、E為NaHSO3,F為H2,C和E反應的離子方程式為:OH-+HSO3-=SO32-+H2O;
②若D為兩性氫氧化物,F為非金屬單質,A與B的反應可以是Al與鹽酸反應或Al與NaOH溶液反應等,故F為H2,C為鋁鹽,X為堿,D為Al(OH)3,E為偏鋁酸鹽,或者F為H2,C為偏鋁酸鹽、X為酸、D為Al(OH)3、E為鋁鹽,X成分可能為HCl或NaOH等;
③若A為紅棕色氣體,X為金屬單質,溶液D中加入KSCN溶液變紅,則D中含有Fe3+,C具有強氧化性,所以A為NO2、B為水、C為HNO3、F為NO、D為Fe(NO3)3、E為Fe(NO3)2。


科目:高中化學 來源: 題型:
【題目】(11分)甲烷水蒸氣催化重整(SMR)是傳統制取富氫混合氣的重要方法,具有工藝簡單、成本低等優點。回答下列問題:
(1)已知1000 K時,下列反應的平衡常數和反應熱:
①CH4(g) ![]() C(s)+2H2(g) K1=10.2 ΔH1
C(s)+2H2(g) K1=10.2 ΔH1
②2CO(g) ![]() C(s)+CO2(g) K2=0.6 ΔH2
C(s)+CO2(g) K2=0.6 ΔH2
③CO(g)+H2O(g) ![]() CO2(g)+H2(g) K3=1.4 ΔH3
CO2(g)+H2(g) K3=1.4 ΔH3
④CH4(g)+2H2O(g) ![]() CO2(g)+4H2(g) K4 ΔH4(SMR)則1000 K時,K4=____________;ΔH4=_________(用ΔH1、ΔH2、ΔH3來表示)。
CO2(g)+4H2(g) K4 ΔH4(SMR)則1000 K時,K4=____________;ΔH4=_________(用ΔH1、ΔH2、ΔH3來表示)。
(2)在進入催化重整裝置前,先要對原料氣進行脫硫操作,使其濃度為0.5 ppm以下。脫硫的目的為______________。
(3)下圖為不同溫度條件下電流強度對CH4轉化率的影響。由圖可知,電流對不同催化劑、不同溫度條件下的甲烷水蒸氣催化重整反應均有著促進作用,則可推知ΔH4____0(填“>”或“<”)。
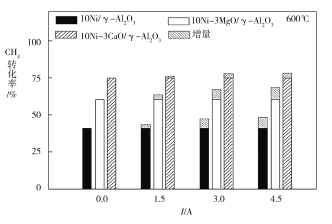
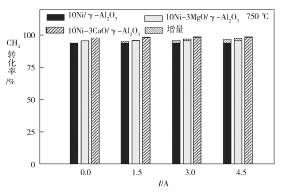
(4)下圖為不同溫度條件下6小時穩定測試電流強度對H2產率的影響。由圖可知,隨著溫度的降低,電流對H2產率的影響作用逐漸____________(填“增加”“減小”或“不變”),600 ℃時,電流對三種催化劑中的____________(用圖中的催化劑表示式回答)影響效果最為顯著,當溫度高于750 ℃時,無論電流強度大小,有無催化劑,H2產率趨于相同,其原因是______________。

(5)我國科學家對甲烷和水蒸氣催化重整反應機理也進行了廣泛研究,通常認為該反應分兩步進行。第一步:CH4催化裂解生成H2和碳(或碳氫物種),其中碳(或碳氫物種)吸附在催化劑上,如CH4→Cads/[C(H)n]ads+(2–![]() )H2;第二步:碳(或碳氫物種)和H2O反應生成CO2和H2,如Cads/[C(H)n]ads +2H2O→CO2 +(2+
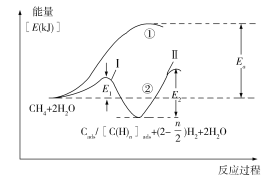
)H2;第二步:碳(或碳氫物種)和H2O反應生成CO2和H2,如Cads/[C(H)n]ads +2H2O→CO2 +(2+![]() )H2。反應過程和能量變化殘圖如下(過程①沒有加催化劑,過程②加入催化劑),過程①和②ΔH的關系為:①_______②(填“>”“<”或“=”);控制整個過程②反應速率的是第_______步,其原因為____________________________。
)H2。反應過程和能量變化殘圖如下(過程①沒有加催化劑,過程②加入催化劑),過程①和②ΔH的關系為:①_______②(填“>”“<”或“=”);控制整個過程②反應速率的是第_______步,其原因為____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)某溫度(t℃)時,測得0.01mol/L的NaOH溶液的pH=11,則該溫度下水的KW=_______。在此溫度下,將pH=a的NaOH溶液Va L與pH=b的H2SO4溶液Vb L混合,若所得混合液為中性,且a+b=12,則Va:Vb=___________。
(2)25℃時,0.1mol/L的HaA溶液中c(H+)/c(OH-)=1010,請回答下列問題:
①HaA是___________(填“強電解質”或“弱電解質”)。
②在加水稀釋HaA溶液的過程中,隨著水量的增加而增大的是__________(填字母)
A.c(HaA) B.c(H+)/c(HaA) C.c(H+)與c(OH-)的乘積 D.c(OH-)
③NanA溶液顯__________(填“酸性”、“中性”或“堿性”),理由是(用離子方程式表示)____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在25 ℃時,向AgCl的白色懸濁液中,依次加入等濃度的KI溶液和Na2S溶液,觀察到的現象是先出現黃色沉淀,最終出現黑色沉淀。已知有關物質的溶度積Ksp(25 ℃)如表所示:
AgCl | AgI | Ag2S | |
Ksp | 1.8×1010 | 8.3×1017 | 6.3×1050 |
下列敘述錯誤的是
A.沉淀轉化的實質就是沉淀溶解平衡的移動
B.溶解度小的沉淀可以轉化為溶解度更小的沉淀
C.AgCl固體在等物質的量濃度的NaCl、CaCl2溶液中的溶解度相同
D.25 ℃時,在飽和AgCl、AgI、Ag2S溶液中,所含Ag+的濃度不同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】活性氧化鋅是一種多功能性的新型無機材料。某小組以粗氧化鋅(含鐵、銅的氧化物)為原料模擬工業生產活性氧化鋅,步驟如圖: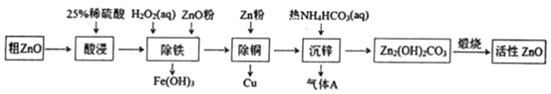
已知相關氫氧化物沉淀pH范圍如表所示
Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
開始沉淀 | 5.4 | 7.0 | 2.3 | 4.7 |
完全沉淀 | 8.0 | 9.0 | 4.1 | 6.7 |
下列說法不正確的是( )
A.“酸浸”中25%稀硫酸可用98%濃硫酸配制,需玻璃棒、燒杯、量簡、膠頭滴管等儀器
B.“除鐵”中用ZnO粉調節溶液pH至4.1~4.7
C.“除銅”中加入Zn粉過量對制備活性氧化鋅的產量沒有影響
D.“沉鋅”反應為2Zn2++4HCO3﹣═Zn2(OH)2CO3↓+3CO2↑+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用標準氫氧化鈉溶液(濃度為0.2812mol/L)測定未知濃度的鹽酸溶液。
(1)寫出化學方程式:____________
(2)滴定時可用_________作指示劑,當溶液由___色變成___色,且0.5min不褪時達到滴定終點。
(3)取20.00mL待測鹽酸溶液,滴定終點時,消耗標準氫氧化鈉30.00mL,待測鹽酸溶液的濃度為________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作或現象不能用勒夏特列原理解釋的是
A. 配制FeCl3溶液
配制FeCl3溶液
B. 酯水解程度比較
酯水解程度比較
C. 探究石灰石與稀鹽酸在密閉環境下的反應
探究石灰石與稀鹽酸在密閉環境下的反應
D. 鹵化銀沉淀的轉化
鹵化銀沉淀的轉化
查看答案和解析>>
科目:高中化學 來源: 題型:
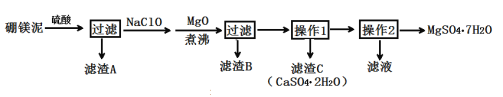
【題目】七水硫酸鎂(MgSO4·7H2O)在印染、造紙和醫藥等工業上有重要的用途。硼鎂泥是硼鎂礦生產硼砂的廢渣,其主要成分是MgCO3,還含有MgO、CaO、Fe2O3、FeO、MnO2、Al2O3、SiO2等雜質,工業上用硼鎂泥制取七水硫酸鎂的工藝流程如圖:
已知:①MnO2不溶于稀硫酸。
②CaSO4和MgSO4·7H2O在不同溫度下的溶解度(g)數據如下表所示:
溫度/℃ 物質 | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.21 | 0.19 |
MgSO4·7H2O | 30.9 | 35.5 | 40.8 | 45.6 | —— |
(1)開始用到硫酸的質量分數為70%,密度為1.61g/cm3,則該硫酸溶液的物質的量濃度為___。
(2)濾渣A中除含少量CaSO4·2H2O外,還有___。
(3)加入MgO后,加熱煮沸的目的是___。
(4)若濾渣B的主要成分為Al(OH)3和Fe(OH)3。則加入NaClO發生氧化還原反應的離子方程式為___。
(5)流程中操作1為蒸發濃縮、趁熱過濾,這樣即可得到CaSO4·2H2O,又防止___。
(6)獲取MgSO4·7H2O的操作2為:___、___、過濾洗滌。
(7)已知開始硼鎂泥樣品的質量為ag,制取七水硫酸鎂的質量為bg,據此能計算出硼鎂泥中鎂元素的含量嗎?若能,請寫出表達式;若不能,請說明理由。___(能或不能),表達式(或理由)為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】圖中反應①是制備SiH4的一種方法,其副產物MgCl2·6NH3是優質的鎂資源。下列說法錯誤的是
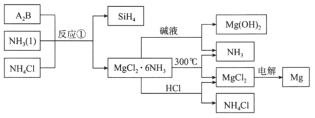
A.A2B的化學式為Mg2Si
B.該流程中可以循環使用的物質是NH3和NH4Cl
C.利用MgCl2·6NH3制取鎂的過程中發生了化合反應、分解反應
D.分別將MgCl2溶液和Mg(OH)2懸濁液加熱、灼燒,最終得到的固體相同
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com