

分析 流程中,向硫酸鈣濁液中通入足量的氨氣,使溶液成堿性,再通人適量的二氧化碳利于反應的進行,硫酸鈣與氨氣、水和二氧化碳反應生成了硫酸銨和碳酸鈣沉淀,加熱制成飽和溶液,再降溫冷卻,結晶析出,過濾,則可以使硫酸銨從溶液中結晶析出.
(1)根據硫酸銨中含有氮元素在農業上可做化學肥料;該流程中硫酸鈣與氨氣、水和二氧化碳反應生成了硫酸銨和碳酸鈣沉淀;
(2)堿性溶液會吸收更多的二氧化碳,利于反應的進行;
(3)根據可以循環使用的f物質參加反應,并且要生成回答,二氧化碳、氨氣參與了化學反應,也是生成物;
(4)硫酸銨由溶液中結晶析出的方法是冷卻熱飽和溶液的方法;
(5)A.氨氣能提供制備所需的氮元素;
B.氨氣溶于水形成的溶液呈堿性,增大CO32-的濃度促進反應發生;
C.氨氣是反應物;
D.設生產132g(NH4)2SO4,至少消耗NH3的質量為x,根據反應CaSO4+2NH3+CO2+H2O=CaCO3↓+(NH4)2SO4來計算.
解答 解:流程中,向硫酸鈣濁液中通入足量的氨氣,使溶液成堿性,再通人適量的二氧化碳利于反應的進行,硫酸鈣與氨氣、水和二氧化碳反應生成了硫酸銨和碳酸鈣沉淀,加熱制成飽和溶液,再降溫冷卻,結晶析出,過濾,則可以使硫酸銨從溶液中結晶析出.
(1)硫酸銨中含有氮元素,在如圖流程中,硫酸鈣與氨氣、水和二氧化碳反應生成了硫酸銨和碳酸鈣沉淀物質發生的主要化學反應為:CaSO4+2NH3+CO2+H2O=CaCO3↓+(NH4)2SO4.故答案為:用作肥料;CaSO4+2NH3+CO2+H2O=CaCO3↓+(NH4)2SO4;
(2)向硫酸鈣濁液中通入足量的氨氣,使溶液成堿性,再通人適量的二氧化碳利于反應的進行;故答案為:B;
(3)二氧化碳、氨氣參與了化學反應,也是生成物,所以二氧化碳可以循環使用,故答案為:CO2、NH3;
(4)使硫酸銨從溶液中結晶析出的方法是先加熱制成飽和溶液,再降溫冷卻,結晶析出,過濾,故答案為:蒸發濃縮、冷卻結晶、過濾;
(5)A.氨氣能提供制備所需的氮元素,故正確;
B.氨氣溶于水形成的溶液呈堿性,增大CO32-的濃度促進反應發生,故正確;
C.氨氣不是作反應的催化劑,故錯誤;
D.設生產132g(NH4)2SO4,至少消耗NH3的質量為x,
CaSO4+2NH3+CO2+H2O=CaCO3↓+(NH4)2SO4
34 132
x 132g
$\frac{34}{x}$=$\frac{132}{132g}$,解得:x=34g,故生產1mol (NH4)2SO4,至少消耗2mol NH3,故正確.
故選:ABD.
點評 本題屬于新信息題,通過一個陌生的反應考查了有關硫酸銨和二氧化碳的知識,因此同學們要充分利用所給的信息,不要被無用的信息迷惑,結合自己已學過的知識,進行有依據性的判斷,難度較大.


科目:高中化學 來源: 題型:實驗題
| 時間t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
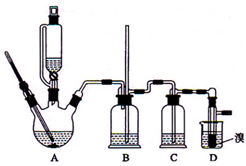 實驗室制備1,2-二溴乙烷的反應原理是先用乙醇制備出乙烯,再將乙烯通入溴水中發生如下反應:CH2=CH2+Br2→BrCH2CH2Br.可能存在的主要副反應有:乙醇在濃硫酸的存在下在l40℃脫水生成乙醚.用少量的溴和足量的乙醇制備1,2-二溴乙烷的裝置如圖所示.回答下列問題:
實驗室制備1,2-二溴乙烷的反應原理是先用乙醇制備出乙烯,再將乙烯通入溴水中發生如下反應:CH2=CH2+Br2→BrCH2CH2Br.可能存在的主要副反應有:乙醇在濃硫酸的存在下在l40℃脫水生成乙醚.用少量的溴和足量的乙醇制備1,2-二溴乙烷的裝置如圖所示.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加熱后在空氣中冷卻稱量固體 | B. | 晶體中含有加熱易揮發的雜質 | ||
| C. | 實驗所取晶體已有部分脫水 | D. | 晶體加熱時脫水不完全 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ①③ | C. | ②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
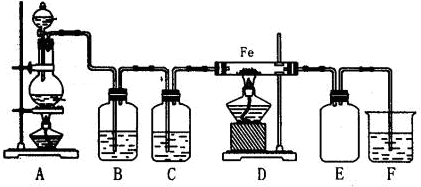
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 恒重操作是指加熱、冷卻、稱量這一過程重復兩次 | |
| B. | 加熱時不斷用玻璃棒攪拌 | |
| C. | 加熱時晶體不小心濺出坩堝,再加一些膽礬 | |
| D. | 為了節約時間,加熱時直接用大火加熱直至最后 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com