
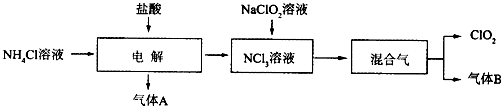
分析 NH4Cl溶液中加入鹽酸進行電解得到NCl3,結合元素守恒可知,生成的氣體A為H2,NCl3溶液中加入NaClO2溶液,得到ClO2與氣體B,氣體B能使濕潤的紅色石蕊試紙變藍,則B為NH3.
(1)由上述分析可知,電解發生反應:NH4Cl+2HCl$\frac{\underline{\;電解\;}}{\;}$NCl3+3H2↑;實驗室用氯化銨與氫氧化鈣在加熱條件下制備氨氣,反應生成氯化鈣、氨氣與水;
由題目信息可知,NCl3極易爆炸,盡量用稀有氣體進行稀釋,在熱水中易分解,電解中應注意:控制好生成NCl3的濃度,控制好反應溫度;
(2)NCl3與NaClO2按物質的量之比為1:6混合,在溶液中恰好反應生成ClO2與NH3,由氫元素守恒可知,有水參加反應,1molNCl3得到1molNH3,由ClO2-、ClO2中Cl原子與O原子之比均為1:2,結合電荷守恒可知,反應還生成NaCl與NaOH;
(3)①碘反應完畢,加入最后一滴Na2S2O3溶液,溶液藍色褪去;
②ClO2與I-反應得到Cl-與I2,由電子轉移守恒及已知反應,可得關系式:2ClO2~5I2~10S2O32-,據此計算V1 mL試樣中ClO2的物質的量,進而計算100mL溶液中ClO2的物質的量,再結合m=nM計算原10mL溶液中ClO2的濃度.
解答 解:NH4Cl溶液中加入鹽酸進行電解得到NCl3,結合元素守恒可知,生成的氣體A為H2,NCl3溶液中加入NaClO2溶液,得到ClO2與氣體B,氣體B能使濕潤的紅色石蕊試紙變藍,則B為NH3.
(1)由上述分析可知,電解發生反應:NH4Cl+2HCl$\frac{\underline{\;電解\;}}{\;}$NCl3+3H2↑;實驗室用氯化銨與氫氧化鈣在加熱條件下制備氨氣,反應生成氯化鈣、氨氣與水,反應方程式為:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
由題目信息可知,NCl3極易爆炸,盡量用稀有氣體進行稀釋,在熱水中易分解,電解中應注意:控制好生成NCl3的濃度,控制好反應溫度;
故答案為:NH4Cl+2HCl$\frac{\underline{\;電解\;}}{\;}$NCl3+3H2↑;2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;控制好反應溫度;
(2)NCl3與NaClO2按物質的量之比為1:6混合,在溶液中恰好反應生成ClO2與NH3,由氫元素守恒可知,有水參加反應,1molNCl3得到1molNH3,由ClO2-、ClO2中Cl原子與O原子之比均為1:2,結合電荷守恒可知,反應還生成NaCl與NaOH,反應離子方程式為:NCl3+6ClO2-+3H2O=6ClO2↑+NH3↑+3Cl-+3OH-,
故答案為:NCl3+6ClO2-+3H2O=6ClO2↑+NH3↑+3Cl-+3OH-,
(3)①碘反應完畢,加入最后一滴Na2S2O3溶液,溶液藍色變為無色,且30s內不變色,說明反應到達終點,
故答案為:溶液藍色變為無色,且30s內不變色;
②ClO2與I-反應得到Cl-與I2,由電子轉移守恒及已知反應,可得關系式:2ClO2~5I2~10S2O32-,則V1 mL試樣中ClO2的物質的量為c mol/L×V2×10-3L×$\frac{1}{5}$,故100mL溶液中ClO2的物質的量為為c mol/L×V2×10-3L×5×$\frac{100mL}{{V}_{1}mL}$,故原10mL溶液中ClO2的質量為c mol/L×V2×10-3L×$\frac{1}{5}$×$\frac{100mL}{{V}_{1}mL}$×68.5g/mol,
ClO2與I-反應得到Cl-與I2,由電子轉移守恒及已知反應,可得關系式:2ClO2~5I2~10S2O32-,則V1 mL試樣中ClO2的物質的量為c mol/L×V2×10-3L×$\frac{1}{5}$,故100mL溶液中ClO2的物質的量為c mol/L×V2×10-3L×$\frac{1}{5}$×$\frac{100mL}{{V}_{1}mL}$,故原10mL溶液中ClO2的質量為c mol/L×V2×10-3L×$\frac{1}{5}$×$\frac{100mL}{{V}_{1}mL}$×67.5g/mol=cV2×10-3×$\frac{1}{5}$×$\frac{100}{{V}_{1}}$×67.5g,即原溶液中ClO2的濃度為(cV2×10-3×$\frac{1}{5}$×$\frac{100}{{V}_{1}}$×67.5g)÷0.01L=$\frac{135c{V}_{2}}{{V}_{1}}$g/L,
故答案為:$\frac{135c{V}_{2}}{{V}_{1}}$.
點評 本題考查物質制備,為高頻考點,涉及氧化還原反應滴定、離子方程式書寫、電解原理等知識點,明確實驗原理、物質性質、實驗基本操作等是解本題關鍵,同時還考查計算能力,知道流程圖中發生的反應及基本操作方法、物質成分等,難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 磷(P)基態原子最外層軌道表示式: | |
| B. | 鋼鐵發生吸氧腐蝕的正極反應式: O2+4H++4e-═2H2O | |
| C. | 葡萄糖的實驗式:C6H12O6 | |
| D. | 氰基的電子式: |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 鐵是目前人類使用量最大的金屬,它能形成多種化合物.
鐵是目前人類使用量最大的金屬,它能形成多種化合物.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子半徑:S>O>N | B. | 沸點:H2O>HF>H2S | ||
| C. | 離子半徑:Cl->Al3+>Mg2+ | D. | 還原性:I->S2->Br- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com