
【題目】人類認識原子結構經歷了幾個階段,其中盧瑟福提出的是( )
A. 古典原子論 B. 近代原子論 C. 葡萄干面包模型 D. 原子結構的模型
 新活力總動員暑系列答案
新活力總動員暑系列答案 龍人圖書快樂假期暑假作業鄭州大學出版社系列答案
龍人圖書快樂假期暑假作業鄭州大學出版社系列答案科目:高中化學 來源: 題型:
【題目】按要求填空
(1)已知實驗室制備氧氣可以通過加熱高錳酸鉀實現,其發生的反應如下:2KMnO4 ![]() K2MnO4+MnO2+O2↑其中被氧化的元素是 , 還原產物是 .
K2MnO4+MnO2+O2↑其中被氧化的元素是 , 還原產物是 .
(2)查閱資料可知:銅和濃H2SO4共熱,發生如下反應:Cu+2H2SO4 ![]() CuSO4+SO2↑+2H2O該反應中氧化劑與還原劑的物質的量之比為 , 其中H2SO4在反應中體現性.
CuSO4+SO2↑+2H2O該反應中氧化劑與還原劑的物質的量之比為 , 其中H2SO4在反應中體現性.
(3)在一定條件下,RO3n﹣和氟氣可發生如下反應:RO3n﹣+F2+2OH﹣=RO4﹣+2F﹣+H2O從而可知在RO3n﹣中元素R的化合價是 .
(4)請用雙線橋表示下列反應方程式中轉移的電子數目及方向:
K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O
若反應中,發生氧化反應的HCl為1.2mol,則被還原的K2Cr2O7物質的量為 mol.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】MgCl2、KCl、K2SO43種鹽配成混合液后,若溶液中n(K+)=1.5 mol、n(Mg2+)=0.5 mol、n(Cl-)=1.5 mol,則溶液中n(SO42-)應為
A. 0.5 molB. 0.25 mol
C. 0.15 molD. 1 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】ClO2是一種消毒、殺菌效率高、二次污染小的水處理劑。實驗室可通過以下反應制得:(已知H2C2O4中的碳為+3價)2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O。試回答下列問題。
(1)該反應中氧化產物的化學式是___________;被還原的元素是___________。
(2)用雙線橋標出上述反應的電子轉移情況______。
2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O
(3)若反應共產生了4.48L氣體(標準狀況),則反應轉移電子的物質的量為_________mol,消耗還原劑的物質的量為___________mol。
(4)標準狀況下44.8mL的ClO2氣體恰好能與50mL 0.1mol·L-1的Na2SO3溶液液完全反應,生成Na2SO4,氯元素在產物中的化合價為___________;此過程說明ClO2具有____(填“氧化”或“還原”)性。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各組物質均屬于分子晶體且均為化合物的是( )
A.NH3、HD、C10H8B.PCl3、CO2、AlCl3
C.SO2、SiO2、P2O5D.CCl4、H2O2、Na2S
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向10mL一定物質的量濃度的鹽酸中滴加一定物質的量濃度的NaOH溶液,其pH變化如圖所示,則兩溶液的物質的量濃度分別是( )
A | B | C | D | |
鹽酸的物質的量濃度 | 0.12 | 0.04 | 0.03 | 0.09 |
NaOH的物質的量濃度 | 0.04 | 0.12 | 0.09 | 0.03 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應:①Cl2+2KBr====2KCl+Br2,②KClO3+6HCl(濃)====3Cl2↑+KCl+3H2O,③2KBrO3+Cl2====Br2+2KClO3,下列說法正確的是 ( )
A. 上述3個反應都是置換反應
B. 氧化性由強到弱的順序為KBrO3>KClO3>Cl2>Br2
C. 反應②中若得到6.72 L Cl2(標準狀況),則電子轉移個數為3.01×1023
D. ③中1 mol氧化劑參加反應得到電子的物質的量為2 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲圖中①、②、③、④表示不同化學元素所組成的化合物,乙圖表示由四個單體構成的化合物。以下說法錯誤的是
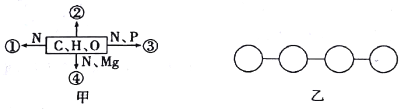
A. 若甲圖中的②是良好的儲能物質,則②是脂肪
B. 若甲圖中④能吸收、傳遞和轉換光能,則④可用無水乙醇提取
C. 若①是乙圖中的單體,則乙表示的化合物為多(或四)肽
D. 若③是脫氧核苷酸,則由③組成的乙徹底水解后的產物有5種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一無色透明的水溶液中能大量共存的離子組是
A.Ba2+、SO42-、K+B.NH4+、Na+、OH-
C.Cu2+、C1-、NO3-D.Na+、C1-、NO3-
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com