
| 弱電解質 | H2CO3 | NH3•H2O |
| 電離平衡常數 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
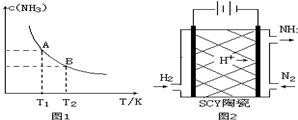
分析 (1)①由圖1可知,溫度越高,平衡時NH3的濃度越小,說明升高溫度平衡向逆反應進行,平衡常數減小;
②令參加反應的氮氣的物質的量為nmol,利用三段式用n表示處于平衡時各組分的物質的量,根據氨氣的體積分數列方程計算n的值,再計算用N2表示的化學反應速率;
③根據平衡常數表達式帶入平衡濃度計算T1溫度下該反應的化學平衡常數K1;
(2)①N2(g)+3H2(g)=2NH3(g)△H1=a kJ/mol
②2H2(g)+O2(g)=2H2O(l)△H2=b kJ/mol
2×①-3×②,得:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),根據蓋斯定律求△H;
(3)由圖可知電解時,陰極與電源的負極相連,氮氣在陰極得電子發生還原反應生成氨氣,據此寫出陰極反應;
(4)①弱電解質的電離平衡常數越小,其相應的弱離子水解程度越大,碳酸第二步電離平衡常數小于一水合氨電離平衡常數,則碳酸根離子水解程度大于一水合氨,據此判斷碳酸鈉溶液酸堿性;
②碳酸根離子水解程度大于銨根離子水解程度,碳酸氫根離子濃度大于一水合氨濃度,溶液中存在電荷守恒和物料守恒,結合電荷守恒、物料守恒和質子守恒判斷.
解答 解:(1)①由圖可知,溫度越高,平衡時NH3的濃度越小,說明升高溫度平衡向逆反應進行,平衡常數減小,故平衡常數KA>KB,溫度越高,K值越小,所以正反應是放熱反應,
故答案為:>;<;
②令參加反應的氮氣的物質的量為nmol,則:
N2(g)+3H2(g)?2NH3(g)
開始(mol):1 3 0
變化(mol):n 3n 2n
平衡(mol):1-n 3-3n 2n
所以所以$\frac{2n}{(1-n)mol+(3-3n)mol+2nmol}$×100%=25%,解得n=0.4,這段時間內N2的化學反應速率為為:$\frac{\frac{0.4mol}{10L}}{5.00min}$=8.00×10-3mol/(L•min),
故答案為:8.00×10-3mol/(L•min);
③N2(g)+3H2(g)?2NH3(g)
開始(mol):1 3 0
變化(mol):0.4 1.2 0.8
平衡(mol):0.6 1.8 0.8
平衡濃度(mol/L) 0.06 0.18 0.08
K1=$\frac{{C}^{2}(N{H}_{3})}{c({N}_{2})•c{\;}^{3}({H}_{2})}$=$\frac{0.08{\;}^{2}}{0.06×0.18{\;}^{3}}$=18.3;
故答案為:18.3;
(2)①N2(g)+3H2(g)=2NH3(g)△H1=a kJ/mol;
②2H2(g)+O2(g)=2H2O(l)△H2=b kJ/mol,
根據蓋斯定律可知,目標反應為2×①-3×②,所以2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=(2a-3b)kJ/mol,
故答案為:(2a-3b)kJ/mol;
(3)電解時,N2在陰極上得電子被還原生成氨氣,氫離子參加反應,陰極反應式為反應式為N2+6H++6e-=2NH3,
故答案為:反應式為N2+6H++6e-=2NH3;
(4):①分析電離平衡常數可知電離程度,NH3•H2O>H2CO3>HCO3-,對應鹽水解程度NH4+<HCO3-<CO32-,常溫下0.1mol•L-1的(NH4)2CO3溶液呈堿性,由于NH3•H2O的電離平衡常數大于HCO3-的電離平衡常數,因此CO32-水解程度大于NH4+水解程度,溶液中c (OH-)>c(H+),溶液呈堿性;
故答案為:堿;由于NH3•H2O的電離平衡常數大于HCO3-的電離平衡常數,因此CO32-水解程度大于NH4+水解程度,溶液呈堿性;
②A.溶液中銨根離子濃度大于碳酸根離子濃度,碳酸根離子水解程度大于銨根離子水解程度,所以溶液中離子濃度大小為:c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3•H2O),故A正確;
B.溶液中存在電荷守恒為:c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故B錯誤;
C.依據溶液中物料守恒得到:c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol•L-1 ,故C正確;
D.依據溶液中物料守恒,n(N):n(C)=2:1,結合溶液中離子種類和守恒關系得到:c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故D正確;
故選:B.
點評 本題考查了反應熱的計算、平衡計算、電解質溶液中的離子平衡、電解池電極反應式的書寫、鹽類水解應用及離子濃度大小比較,中等難度,準確把握化學平衡理論及電解池工作原理、明確電離平衡常數與弱離子水解程度關系是解本題關鍵,注意守恒思想的靈活運用.


科目:高中化學 來源: 題型:選擇題
| A. | ①④ | B. | ①② | C. | ③⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 鄭州一中是一所具有豐厚的歷史積淀、獨特的精神內涵,以關注學生智慧與靈魂為學校文化內核,充滿創新精神,能夠培養具有國際視野的拔尖人才,擁有核心競爭力的國內名校.目前一中教育集團包含小學部、初中部、高中部三個學部的十余所學校.學校以主體課堂教學為載體,以培養學生的創新思維和實踐能力為目標,在教學活動中特別注重學生科學素養的提升,如對于I A和ⅥA族重要元素化合物的性質,各校區根據實際情況開展了豐富多彩的探究活動.
鄭州一中是一所具有豐厚的歷史積淀、獨特的精神內涵,以關注學生智慧與靈魂為學校文化內核,充滿創新精神,能夠培養具有國際視野的拔尖人才,擁有核心競爭力的國內名校.目前一中教育集團包含小學部、初中部、高中部三個學部的十余所學校.學校以主體課堂教學為載體,以培養學生的創新思維和實踐能力為目標,在教學活動中特別注重學生科學素養的提升,如對于I A和ⅥA族重要元素化合物的性質,各校區根據實際情況開展了豐富多彩的探究活動. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 時間t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 總壓強p/100kPa | 4.80 | 5.44 | 5.76 | 5.92 | 6.00 | 6.00 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鋼鐵制品的腐蝕常以析氫腐蝕為主 | |
| B. | 廚房中常用碳酸鈉溶液洗滌餐具上的油污 | |
| C. | 明礬[KAl(SO4)2•12H2O]用于水的殺菌消毒 | |
| D. | 新型材料聚酯纖維、光導纖維都屬于有機高分子材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

 ,在該反應中濃鹽酸表現了還原性和酸性.
,在該反應中濃鹽酸表現了還原性和酸性.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com