
根據如圖的轉化關系判斷下列說法正確的是(反應條件已略去)

A. 反應①②③④⑤均屬于氧化反應和離子反應
B.反應⑤說明該條件下鋁的還原性強于錳
C.相同條件下生成等量的O2,反應③和④轉移的電子數之比為1:1
D.反應①中氧化劑與還原劑的物質的量之比為1:4
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2016-2017學年河北省高二上學期摸底化學試卷(解析版) 題型:選擇題
用NA表示阿伏伽德羅常數的數值,下列說法正確的是( ).
A.標準狀況下,11.2L H2O所含的水分子數目為0.5NA
B.16g O2和O3的混合氣體中所含的氧原子數目為NA
C.1.00mol/L Na2CO3溶液中所含Na+的數目為2NA
D.0.1mol Zn與含0.1mol HCl的鹽酸充分反應,產生H2數目為0.2NA
查看答案和解析>>
科目:高中化學 來源:2017屆新疆生產建設兵團二中高三上第一次月考化學試卷(解析版) 題型:填空題
金屬材料在日常生產生活中有著廣泛的應用,請回答下列問題:
(1)人類最早使用的合金是___________,目前使用量最大的金屬是________。
(2)鐵和鐵合金是日常生活中的常用材料,下列敘述正確的是________。
A.純鐵的硬度比生鐵高
B.純鐵耐腐蝕性強,不易生銹
C.不銹鋼是鐵合金,只含金屬元素
D.鐵在一定條件下,可與水蒸氣反應
E.鐵在冷的濃硫酸中會鈍化
(3)向沸水中滴入幾滴飽和FeCl3溶液,加熱至液體呈透明的紅褐色,該反應的離子方程式為__________,形成的分散系中分散質的微粒直徑范圍是_________。
(4)向硫酸亞鐵溶液中加入過氧化鈉,有紅褐色沉淀生成,如果加入的Na2O2與生成的O2的物質的量之比為3:1,請寫出發生的離子反應方程式___________________。
(5)電子工業需要用30%的FeCl3溶液腐蝕絕緣板上的銅,制造印刷電路板。請寫出FeCl 3 溶液與銅反應的離子方程式:_________________,向腐蝕后的廢液中加入一定量的鐵粉充分反應后,無固體剩余,則反應后的溶液中一定含有的離子是___________,可能含有的離子是_________。如果從腐蝕后的廢液中回收銅并重新獲得FeCl3溶液,現有下列試劑:①氯氣②鐵粉③濃硝酸④濃鹽酸⑤燒堿⑥濃氨水。需要用到的一組試劑是_______。
A.①②④ B.①③④⑥ C.②④⑤ D.①④⑥
(6)高鐵酸鈉(Na2FeO4)是一種新型凈水劑。高鐵酸鈉的制備方法之一是:在堿性條件下用NaClO氧化Fe3+,請寫出該反應的離子反應方程式______________。
(7)有一種鐵的氧化物樣品,用5mol/L鹽酸140mL,恰好完全溶解,所得溶液還能吸收標況下0.56L氯氣,恰好使其中Fe2+全部轉化成Fe3+,該氧化物的化學式是_____________。
查看答案和解析>>
科目:高中化學 來源:2017屆新疆生產建設兵團二中高三上第一次月考化學試卷(解析版) 題型:選擇題
在強酸性溶液中能大量共存,且溶液為無色透明的離子組是( )
A.Na+、A13+、SO42-、NO3- B.Ba2+、Na+、SO42-、NO3-
C.K+、Mg2+、MnO4-、SO42- D.K+、Na+、NO3-、HCO3-
查看答案和解析>>
科目:高中化學 來源:2017屆新疆生產建設兵團二中高三上第一次月考化學試卷(解析版) 題型:選擇題
下列說法正確的是( )
A.用KSCN溶于檢驗Fe2(SO4)3溶液中是否含有FeSO4
B.由同種元素組成的物質一定是純凈物
C.將鋼閘門與電源正極相連,可防止其在海水中被腐蝕
D.濁液、膠體、溶液三種分散系的本質區別是分散質微粒直徑的大小不同
查看答案和解析>>
科目:高中化學 來源:2017屆湖南省高三上學期第二次月考化學試卷(解析版) 題型:選擇題
根據下表信息,判斷以下敘述正確的是
部分短周期元素的原子半徑及主要化合價
元素代號 | G | L | M | Q | R | T |
原子半徑/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.075 | 0.066 |
主要化合價 | +1 | +2 | +3 | +6、﹣2 | +5、﹣3 | ﹣2 |
A.單質的還原性:G<L<M B.非金屬性:T<Q
C.氣態氫化物的穩定性:R>T D.L2+與T2﹣的核外電子數相等
查看答案和解析>>
科目:高中化學 來源:2017屆河南省高三上第一次周練化學試卷(解析版) 題型:實驗題
鋰被譽為“金屬味精”,以LiCoO2為正極材料的鋰離子電池已被廣泛用作便攜式電源。工業上常以β?鋰輝礦(主要成分為LiAlSi2O6,還含有FeO、MgO、CaO等雜質)為原料來制取金屬鋰。其中一種工藝流程如下:
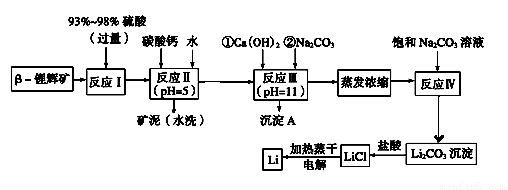
已知:
①部分金屬氫氧化物開始沉淀和完全沉淀時的pH:
氫氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
開始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同溫度下的溶解度如下表:
溫度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
請回答下列問題:
(1)用氧化物形式表示LiA lSi2O6的組成:_______________________
lSi2O6的組成:_______________________
(2)反應Ⅱ加入碳酸鈣的作用是____________________
(3)寫出反應Ⅲ中生成沉淀A的離子方程式:____________________
(4)洗滌所得Li2CO3沉淀要使用“熱水”還是“冷水”理由是____________________
(5)流程中兩次使用了Na2CO3溶液,第一次濃度小,第二次濃度大的原因是____________________
(6)該工藝中,電解熔融氯化鋰生產鋰時,陽極產生的氯氣中會混有少量氧氣,原因是____________________
查看答案和解析>>
科目:高中化學 來源:2016-2017學年山東省淄博市高二上學期開學測化學試卷(解析版) 題型:選擇題
下列選用的試劑能達到對應實驗目的的是
| 實驗目的 | 選用試劑 |
A | 檢驗FeCl2溶液是否變質 | KSCN溶液 |
B | 除去氨氣中的水蒸氣 | 濃H2SO4 |
C | 除去乙酸乙酯中的乙酸 | NaOH溶液 |
D | 除去二氧化碳中少量的氯化氫氣體 | NaOH溶液 |
查看答案和解析>>
科目:高中化學 來源:2016-2017學年遼寧省大連市高二上9月月考化學試卷(解析版) 題型:選擇題
現有下列兩個圖像:下列反應中符合兩圖像的是

A.N2(g)+3H2(g)≒2NH3(g) ΔH<0
B.2SO3(g)≒2SO2(g)+O2(g) ΔH>0
C.4NH3(g)+5O2(g)≒4NO(g)+6H2O(g) ΔH<0
D.H2(g)+CO(g)≒C(s)+H2O(g) ΔH<0
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com