
【題目】下表是不同溫度下水的離子積數據:
溫度/℃ | 25 | t1 | t2 |
水的離子積常數 | 1×10-14 | α | 1×10-12 |
試回答以下問題:
(1)若25<t1<t2,則α__(填“<”“>”或“=”)1×10-14,作出此判斷的理由是___。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取該溶液1mL,加水稀釋至10 mL,則稀釋后溶液中c(Na+)∶c(OH-)=___。
(3)t2℃下,將pH=11的苛性鈉溶液V1L與pH=1的稀硫酸V2L混合(設混合后溶液的體積為原兩溶液體積之和),所得混合溶液的pH=2,則V1∶V2=___。
【答案】> 升高溫度,水的電離程度增大,離子積增大 1000∶1 9∶11
【解析】
(1).水的電離是吸熱的,所以升溫促進水的電離,電離平衡常數增大,即α>1×10-14;
(2) Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,則鈉離子濃度為10-3 mol·L-1,加水稀釋,鈉離子濃度變為10-4 mol·L-1,溶液中的氫氧根離子濃度為10-7 mol·L-1,二者比例為10-4:10-7=1000∶1;
(3) t2℃下,將pH=11的苛性鈉溶液V1L氫氧根離子濃度為10-1 mol·L-1,與pH=1的稀硫酸V2L中氫離子濃度為10-1 mol·L-1,混合(設混合后溶液的體積為原兩溶液體積之和),所得混合溶液的pH=2 ,則有![]() ,解V1:V2=9∶11。
,解V1:V2=9∶11。


 科學實驗活動冊系列答案
科學實驗活動冊系列答案科目:高中化學 來源: 題型:
【題目】向某密閉容器中加入0.3molA、0.1molC和一定量B三種氣體。一定條件下發生反應,各物質濃度隨時間變化如圖甲所示[t0~t1階段c(B)未畫出]。圖乙為t2時刻后改變條件,平衡體系中反應速率隨時間變化的情況,且四個階段都各改變一種條件并且所用條件均不相同。已知t3~t4階段為使用催化劑。下列說法正確的是( )
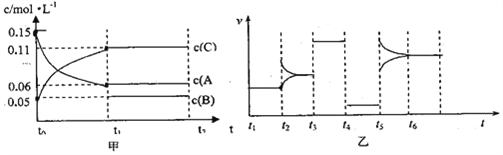
A. 若t1等于15s,生成物C在t0~t1時間段的平均反應速率為0.004mol/(Ls)
B. t4~t5階段改變的條件為降低反應溫度
C. B的起始的物質的量為0.02mol
D. t5~t6階段可能是增大壓強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氣與氧氣生成水的反應是氫能源應用的重要途徑。下列有關說法正確的是
A. 一定溫度下,反應2H2(g)+O2(g) ![]() 2H2O(g)能自發進行,該反應的ΔH<0
2H2O(g)能自發進行,該反應的ΔH<0
B. 氫氧燃料電池的負極反應為O2+2H2O+4e![]() 4OH
4OH
C. 常溫常壓下,氫氧燃料電池放電過程中消耗11.2 L H2,轉移電子的數目為6.02×1023
D. 反應2H2(g)+O2(g) ![]() 2H2O(g)的ΔH可通過下式估算:
2H2O(g)的ΔH可通過下式估算:
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在其他條件不變時,只改變某一條件,化學反應aA(g)+B(g)![]() cC(g)的平衡的變化圖象如下(圖中p表示壓強,T表示溫度,n表示物質的量,α表示平衡轉化率),據此分析下列說法正確的是
cC(g)的平衡的變化圖象如下(圖中p表示壓強,T表示溫度,n表示物質的量,α表示平衡轉化率),據此分析下列說法正確的是

A. 在圖象反應Ⅰ中,說明正反應為吸熱反應
B. 在圖象反應Ⅰ中,若p1>p2,則此反應的ΔS>0
C. 在圖象反應Ⅱ中,說明該正反應為吸熱反應
D. 在圖象反應Ⅲ中,若T1>T2,則該反應能自發進行
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在80℃時,將0.40 mol的四氧化二氮氣體充入2 L的固定容積的密閉容器中,隔一段時間對該容器內的物質進行分析,得到如下數據:
時間/s | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/mol·L-1 | 0.20 | a | 0.10 | c | d | e |
c(NO2)/mol·L-1 | 0.00 | 0.12 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)該反應的化學方程式為________________________。
(2)該反應在0~20 s內N2O4的平均反應速率為____________。
(3)在80℃時該反應的平衡常數K值為______________。
(4)在20s時,濃度熵Qc_________(填“>”、“<”或“=”)平衡常數K。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬及其相關化合物在化工、醫藥、材料等領域有著廣泛的應用。回答下列問題:
(1)下列關于金屬及金屬鍵的說法不正確的是______。(填字母代號)
a.金屬鍵沒有方向性與飽和性
b.金屬鍵是金屬原子與自由電子間的相互作用
c.金屬熔沸點不同的原因可以用金屬鍵強弱解釋
d.電子氣理論可解釋金屬材料的延展性,不能解釋金屬有良好的導電性
(2)釩廣泛用于催化及鋼鐵工業,基態釩原子的價層電子排布圖為_________________。
(3)二茂鐵又叫雙環戊二烯基鐵[Fe(C5H5)2],熔點是172.5~173 ℃,100 ℃以上升華,二茂鐵屬于_____晶體。已知分子中的大π鍵可用符號![]() 表示,其中m代表參與形成大π鍵的原子數,n代表參與形成大π鍵的電子數(如苯分子中的大π鍵可表示為
表示,其中m代表參與形成大π鍵的原子數,n代表參與形成大π鍵的電子數(如苯分子中的大π鍵可表示為![]() )。已知二茂鐵的每個茂環帶有一個單位負電荷,則每個環中的大π鍵應表示為________________。
)。已知二茂鐵的每個茂環帶有一個單位負電荷,則每個環中的大π鍵應表示為________________。
(4)銅可以形成一種離子化合物[Cu(NH3)4(H2O)2]SO4,若要確定[Cu(NH3)4(H2O)2]SO4是晶體還是非晶體,最科學的方法是對其進行______實驗,其中陰離子的空間構型是_____,該化合物加熱時首先失去的組分是H2O,原因是_______________________。
(5)最近發現,只含鎂、鎳和碳三種元素的晶體也具有超導性,該物質形成的晶體的立方晶胞結構如圖所示。
①與Mg緊鄰的Ni有________個。
②原子坐標參數可表示晶胞內部各原子的相對位置。該晶胞中原子的坐標參數為a為(0,0,0);b為(1/2,1/2,0);d為(1,1,1)。則c原子的坐標參數為_______。
③若晶胞中Ni、Mg之間的最短距離為a pm,阿伏加德羅常數的值為NA,則晶體的密度ρ=______g·cm-3(用含a、NA的代數式表示)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】給格列汀![]()

![]() 是用于治療2型糖尿病的藥物,工業上以烴A為基本原料合成給格列汀的過程如下。
是用于治療2型糖尿病的藥物,工業上以烴A為基本原料合成給格列汀的過程如下。
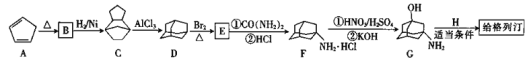
已知:![]()
![]() 的分子式是__________,A生成B的反應類型為______________。
的分子式是__________,A生成B的反應類型為______________。
![]() 中所含官能團的名稱為__________。
中所含官能團的名稱為__________。
![]() 給格列汀
給格列汀![]() ,則H的結構簡式為______,C、D不可能_____
,則H的結構簡式為______,C、D不可能_____![]() 填字母
填字母![]() 。
。
![]() 互為同分異構體
互為同分異構體 ![]() 互為同系物
互為同系物 ![]() 是環烷烴
是環烷烴 ![]() 發生氧化反應
發生氧化反應
![]() 寫出D生成E的化學方程式:_____________________。
寫出D生成E的化學方程式:_____________________。
![]() 有許多同分異構體,其中分子中含有兩種官能團的同分異構體共有______種,寫出一種核磁共振氫譜圖中有4個峰的物質的結構簡式:_________。
有許多同分異構體,其中分子中含有兩種官能團的同分異構體共有______種,寫出一種核磁共振氫譜圖中有4個峰的物質的結構簡式:_________。
![]() 寫出以
寫出以![]() 丁烯為原料合成重要的有機合成中間體
丁烯為原料合成重要的有機合成中間體![]()
![]()
![]() 的流程路線圖
的流程路線圖![]() 無機試劑任選
無機試劑任選![]() ____________
____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】屈昔多巴( )可治療直立性低血壓所致頭昏、頭暈和乏力,帕金森病患者的步態僵直等。以下是屈昔多巴的一種合成路線(通常
)可治療直立性低血壓所致頭昏、頭暈和乏力,帕金森病患者的步態僵直等。以下是屈昔多巴的一種合成路線(通常![]() 簡寫為BnCl,
簡寫為BnCl,![]() 簡寫為CbzCl ):
簡寫為CbzCl ):

回答下列問題:
(1)反應①的反應類型為_____________,其作用為_________________。
(2)屈昔多巴中所含的非含氧官能團名稱為_______________,屈昔多巴分子中有___________個手性碳原子。
(3)反應②為加成反應,有機物X的名稱為______________________。
(4)![]() 顯________________性(填“酸”、“中”或“堿”),寫出其與鹽酸反應的化學方程式:_______________________。
顯________________性(填“酸”、“中”或“堿”),寫出其與鹽酸反應的化學方程式:_______________________。
(5)![]() 的同分異構體中,能與NaHCO3溶液反應生成CO2的二取代芳香化合物有_______種,其中核磁共振氫譜為四組峰的結構簡式為______________(任寫一種)。
的同分異構體中,能與NaHCO3溶液反應生成CO2的二取代芳香化合物有_______種,其中核磁共振氫譜為四組峰的結構簡式為______________(任寫一種)。
(6)參照上述合成路線,以對羥基苯甲醛為原料(無機試劑任選),設計制備對羥基苯甲酸的合成路線:______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】生態溶液涉及農家肥料的綜合利用,某種肥料經發酵得到一種含有甲烷、二氧化碳、氮氣的混合氣體。2.016L(標準狀況)該氣體通過盛有紅色CuO粉末的硬質玻璃管,發生的反應為:CH4+4CuO![]() CO2+2H2O+4Cu。當甲烷完全反應后,硬質玻璃管的質量減輕4.8g。將反應后產生的氣體通過過量的澄清石灰水,充分吸收,生成沉淀8.5g。
CO2+2H2O+4Cu。當甲烷完全反應后,硬質玻璃管的質量減輕4.8g。將反應后產生的氣體通過過量的澄清石灰水,充分吸收,生成沉淀8.5g。
(1)原混合氣體中甲烷的物質的量是____________。
(2)原混合氣體中氮氣的體積分數為多少?(寫出計算過程)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com