
| t/s | 0 | 500 | 1000 |
| c(N2O5/mol/L) | 5.00 | 3.50 | 2.50 |
分析 (一)(1)①恒溫恒容下,通入氮氣,反應混合物個組分的濃度不變,平衡不移動;
(2)由圖可知,500s內N2O5的濃度變化量為5mol/L-3.50mol/L=1.5mol/L,根據v=$\frac{△c}{△t}$計算N2O5的分解速率;
(3)由表中數據可知,在T2溫度下,反應1000s時測得N2O5的濃度為3mol•L-1L,反應為吸熱反應,高于在T1溫度下,反應1000s時測得NO2的濃度,說明該溫度下反應正向進行程度小;
(二)(1)先寫出方程式,再根據物質的量之比等于熱量比求出反應熱;
(2)當兩種沉淀共存時,溶液是AgCl和AgBr的飽和溶液,溶液中 $\frac{c(B{r}^{-})}{c(C{l}^{-})}$=$\frac{Ksp(AgBr)}{Ksp(AgCl)}$,依此計算;
(3)Na2S和NaHS的混合溶液顯堿性,NaHS以水解為主,據此判斷.
解答 解:(一)(1)①恒溫恒容下,通入氮氣,反應混合物個組分的濃度不變,平衡不移動,N2O5的轉化率不變,故答案為:不變;
(2)由圖可知,500s內N2O5的濃度變化量為5mol/L-3.5mol/L=1.5mol/L,故N2O5的分解速率為$\frac{1.5molL}{500s}$=3.00×10-3mol/(L.s);
故答案為:3.00×10-3mol/(L.s);
(3)由表中數據可知,在T2溫度下,反應1000s時測得N2O5的濃度為3.00mol/L,高于在T1溫度下,反應1000s時測得NO2的濃度,說明該溫度下反應正向進行程度小,故溫度T2<T1,
故答案為:<;
(二)(1)BaSO4與碳在高溫下反應的方程式為:BaSO4(s)+4C(s)═4CO(g)+BaS(s),每1mol碳生成CO需要吸收142.8kJ的熱量,所以△H=+571.2kJ/mol,此反應的熱化學方程為:BaSO4(s)+4C(s)═4CO(g)+BaS(s)△H=+571.2kJ/mol,
故答案為:BaSO4(s)+4C(s)═4CO(g)+BaS(s)△H=+571.2kJ/mol;
(2)當兩種沉淀共存時,溶液中Ag+離子濃度相同,根據溶度積常數計算,c(Br-)=$\frac{Ksp(AgBr)}{c(A{g}^{+})}$,c(Cl-)=$\frac{Ksp(AgCl)}{c(A{g}^{+})}$,
則$\frac{c(B{r}^{-})}{c(C{l}^{_})}$=$\frac{Ksp(AgBr)}{Ksp(AgCl)}$=$\frac{5.4×1{0}^{-13}}{2.0×1{0}^{-10}}$=2.7×10-3,
故答案為:2.7×10-3;
(3)Na2S和NaHS的混合溶液顯堿性即c(OH-)>c(H+),NaHS以水解為主,則c(HS-)>c(S2-),
所以溶液中各離子濃度由大到小的順序為c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+),
故答案為:c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+).
點評 本題為拼合型,涉及化學反應速率計算、化學平衡移動與計算、平衡常數的計算與運用、電解原理等知識點,題量大,計算量較大,是對學生心理素質的考驗,題目難度中等,注意掌握平衡常數在化學平衡計算的運用.


科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②⑥⑤⑦⑥ | B. | ④⑥③⑦⑤⑥ | C. | ②⑥③⑦⑤⑥ | D. | ①⑥③⑤⑥⑦ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
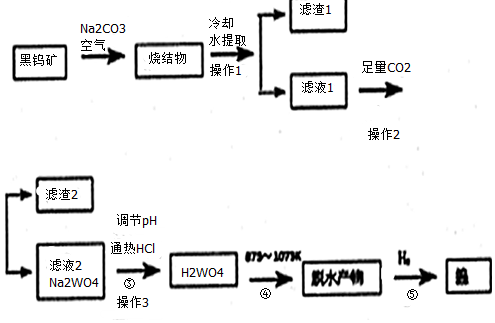
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
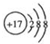 .
.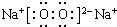 ,該產物所含有的化學鍵類型有離子鍵、非極性鍵.
,該產物所含有的化學鍵類型有離子鍵、非極性鍵.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 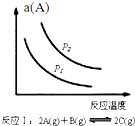 如圖反應:△H<0,P2>P1 | |
| B. |  如圖反應:△H<0,T1>T2 | |
| C. |  如圖反應:△H>0,T2>T1 | |
| D. |  如圖反應:△H>0,T2>T1或△H<0,T2<T1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

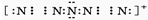 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO4-和NO3-可能來自同一工廠 | B. | Cl-和NO3-一定來自不同的工廠 | ||
| C. | Ag+和Na+可能來自同一工廠 | D. | Na+和NO3-來自同一工廠 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com