
分析 (1)根據兩性氧化物能與酸反應生成鹽和水;根據Be(NO3)2溶液中逐滴加入等濃度的NaOH先后發生反應:Be(NO3)2+2NaOH=Be(OH)2↓+2NaNO3,Be(OH)2+2NaOH═Na2BeO2+2H2O,先產生沉淀,然后沉淀消失,兩次消耗的氫氧化鈉的物質的量都為0.02mol(即20mLNaOH溶液),產生的Be(OH)2沉淀為0.01mol;
(2)①根據質量守恒書寫方程式;
②A.GeO2與SiO2性質不相似,GeO2與鹽酸反應,SiO2與鹽酸不反應;
B.過程Ⅱ的蒸餾是利用GeCl4的沸點低來實現的;
C.過程Ⅳ發生的反應中,GeO2中Ge的化合價降低,作氧化劑;
D.過程Ⅰ、Ⅲ是復分解反應,過程Ⅳ是置換反應;
(3)將硫與濃硝酸混合,結果生成一種純凈無色氣體A,A遇空氣變紅棕色,說明A為一氧化氮,由于濃硝酸的強氧化性,能將硫氧化成+6價的硫酸,然后根據質量守恒配平;
解答 解:(1)BeO與鹽酸反應的生成氯化鈹和水,反應的離子方程式為:BeO+2H+=Be2++H2O;Be(NO3)2溶液中逐滴加入等濃度的NaOH先后發生反應:Be(NO3)2+2NaOH=Be(OH)2↓+2NaNO3,Be(OH)2+2NaOH═Na2BeO2+2H2O,先產生沉淀,然后沉淀消失,兩次消耗的氫氧化鈉的物質的量都為0.02mol(即20mLNaOH溶液),產生的Be(OH)2沉淀為0.01mol,沉淀量隨NaOH溶液加人量的變化圖為: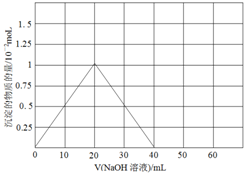 ;
;
故答案為:BeO+2H+=Be2++H2O; ;
;
(2)①GeCl4與水反應生成GeO2和氯化氫,方程式為:GeCl4+2H2O=GeO2+4HCl;
故答案為:GeCl4+2H2O=GeO2+4HCl;
②A.GeO2與SiO2性質不相似,GeO2與鹽酸反應,SiO2與鹽酸不反應,故A錯誤;
B.過程Ⅱ的蒸餾是利用GeCl4的沸點低來實現的,不是利用GeCl4難溶于水的性質實現的,故B錯誤;
C.過程Ⅳ發生的反應中,GeO2中Ge的化合價降低,作氧化劑,故C正確;
D.過程Ⅰ、Ⅲ是復分解反應,過程Ⅳ是置換反應,屬于氧化還原反應,故D正確;
故答案為:CD;
(3)將硫與濃硝酸混合,結果生成一種純凈無色氣體A,A遇空氣變紅棕色,說明A為一氧化氮,由于濃硝酸的強氧化性,能將硫氧化成+6價的硫酸,化學方程式為:S+2HNO3=H2SO4+2NO↑;
故答案為:S+2HNO3=H2SO4+2NO↑.
點評 本題主要考查了同主族元素性質的相似性和差異性,注意根據題意提取信息是解題的關鍵,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ②④⑤⑥ | C. | ①②④ | D. | ①②④⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 在周期表中1~36號之間的A、B、C、D、E、F六種元素,它們的原子序數依次增大,已知A與其余五種元素既不同周期也不同主族,B的一種核素在考古時常用來鑒定一些文物的年代,C元素原子的最外層有3個自旋方向相同的未成對電子,D原子核外電子有8種不同的運動狀態,E元素在第四周期,E的基態原子中未成對電子數是核外電子總數的$\frac{1}{4}$,F元素位于周期表的ds區,其基態原子最外能層只有一個電子.
在周期表中1~36號之間的A、B、C、D、E、F六種元素,它們的原子序數依次增大,已知A與其余五種元素既不同周期也不同主族,B的一種核素在考古時常用來鑒定一些文物的年代,C元素原子的最外層有3個自旋方向相同的未成對電子,D原子核外電子有8種不同的運動狀態,E元素在第四周期,E的基態原子中未成對電子數是核外電子總數的$\frac{1}{4}$,F元素位于周期表的ds區,其基態原子最外能層只有一個電子. .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | v(B)=1.5 mol•L-1•min-1 | B. | v(B)=3 mol•L-1•min-1 | ||
| C. | v(D)=2 mol•L-1•min-1 | D. | v(C)=1 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
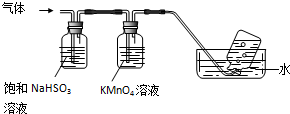
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
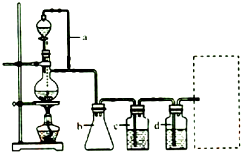

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
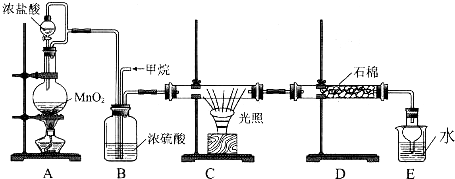
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某化合物焰色反應呈黃色,說明該物質中一定含有Na+ | |
| B. | 向某溶液中加入鹽酸有氣泡產生,說明一定有CO32- | |
| C. | 向某溶液中加入氯化鋇溶液,有白色沉淀產生,說明一定有SO42- | |
| D. | 向某溶液中加入硝酸銀溶液,有白色沉淀產生,說明一定有Cl- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com