
實驗室以空氣(O2體積分數20%)為原料,在無碳、無水的環境下,用下圖A裝置制備臭氧(3O2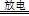 2O3)。
2O3)。
(1)空氣通入A裝置之前,應先后通過上述裝置中的 、 (填裝置序號)。
(2)臭氧與碘化鉀溶液反應為:2KI+O3+H2O=2KOH+I2+O2。將a處氣體通入裝置B,溶液中的現象為 。
(3)為測定O2轉化為O3的轉化率,將裝置B中的溶液全部轉入另一容器中,加入CC14,經萃取、分液、蒸餾、冷卻、稱重,得I2固體0.254g。
①萃取操作所用玻璃儀器的名稱 。
②若實驗時通入空氣1.12L(標準狀況),O2的轉化率為 。
③測定時需在A、B裝置間連接裝置D,原因是 。
(4)工業上分離O3和O2,可將混合氣體液化后再分離,下列分離方法合理的是 (填序號)。
A.過濾 B.分餾 C.分液 D.萃取
(5)臭氧可用于含CN一堿性電鍍廢水的處理。第i步:CN一轉化為OCN-;第ii步:OCN一繼續轉化為CO32一及兩種單質氣體。若第ii步轉化時,O3與OCN-物質的質量之比為3∶2,該步反應的離子方程式為 。
(15分)(1)D、C(各1分,2分)
(2)溶液變黃色(其他合理答案給分,2分)
(3)①分液漏斗(1分)
②15%(3分)
③除去混合氣體中的氮氧化物(其他合理答案給分,2分)
(4)B(2分)
(5)2OCN—+2OH—+3O3=2CO32一+N2+3O2+H2O(3分)
【解析】
試題分析:(1)根據無碳無水環境條件,則空氣通入A裝置前應先后通過NaOH溶液、濃H2SO4的洗氣瓶;(2)a處氣體通入B,臭氧能氧化KI,溶液中因生成的I2變黃;(3)①萃取使用分液漏斗、燒杯;②由m/M可知n(I2)=0.254g÷254g/mol=0.001mol,由2KI+O3+H2O=2KOH+I2+O2可知,n(O3)=0.001mol,由3O2 2O3可知,n(O2)=0.0015mol,由V/Vm可知n(空氣)=0.05mol,由空氣的組成可知,n(O2)=0.01mol,因此O2得轉化率為0.0015÷0.01×100%=15%;③NaOH溶液能除去空氣中氮氣和氧氣在放電時產生的氮氧化物,防止NO2與KI溶液反應;(4)臭氧和氧氣先液化,二者沸點不同,可用分餾的方法分離,故B正確;(5)第一步反應中碳元素由+2價升為+4價,第二步反應中氮元素由—3價升為0價,部分氧元素由0價將為—2價,則兩步反應分別為O3+CN—=OCN—+O2、2OCN—+2OH—+3O3=2CO32一+N2+3O2+H2O。
2O3可知,n(O2)=0.0015mol,由V/Vm可知n(空氣)=0.05mol,由空氣的組成可知,n(O2)=0.01mol,因此O2得轉化率為0.0015÷0.01×100%=15%;③NaOH溶液能除去空氣中氮氣和氧氣在放電時產生的氮氧化物,防止NO2與KI溶液反應;(4)臭氧和氧氣先液化,二者沸點不同,可用分餾的方法分離,故B正確;(5)第一步反應中碳元素由+2價升為+4價,第二步反應中氮元素由—3價升為0價,部分氧元素由0價將為—2價,則兩步反應分別為O3+CN—=OCN—+O2、2OCN—+2OH—+3O3=2CO32一+N2+3O2+H2O。
考點:考查物質的制備、KI的主要性質、萃取、氧氣轉化率的計算、氮氧化物的產生和處理、分餾、氧化還原反應、離子方程式的書寫等相關知識。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 Ⅰ高純MnCO3是制備高性能磁性材料的主要原料.
Ⅰ高純MnCO3是制備高性能磁性材料的主要原料.
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

| ||
| ||

| 高溫 |
| 高溫 |
| 高溫 |
查看答案和解析>>
科目:高中化學 來源: 題型:
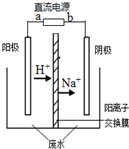 最近有研究人員發現了一種處理高濃度乙醛廢水的新方法-隔膜電解法,乙醛分別在陰、陽極發生反應,轉化為乙醇和乙酸.實驗室以一定濃度的乙醛-Na2SO4溶液為電解質溶液,模擬乙醛廢水的處理過程,其裝置如圖所示.下列說法正確的是( )
最近有研究人員發現了一種處理高濃度乙醛廢水的新方法-隔膜電解法,乙醛分別在陰、陽極發生反應,轉化為乙醇和乙酸.實驗室以一定濃度的乙醛-Na2SO4溶液為電解質溶液,模擬乙醛廢水的處理過程,其裝置如圖所示.下列說法正確的是( )查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com