

分析 (1)甲醇和甲酸反應生成甲酸甲酯和水;
(2)酯化反應中濃硫酸起到催化劑的作用,甲酸甲酯不溶于飽和碳酸鈉,且碳酸鈉可與甲酸反應;
(3)甲醇(CH3OH)易揮發,且有毒;冷凝管應從下口進水,上口出水;
(4)甲醇是有毒的易揮發的有機物,應在密閉容器中進行.
解答 解:(1)甲酸和甲醇進行酯化反應的歷程是羧酸脫羥基醇脫氫,甲醇和甲酸反應生成甲酸甲酯和水,化學方程式為:HCOOH+CH3OH$?_{△}^{濃硫酸}$HCOOCH3+H2O,
故答案為:HCOOH+CH3OH$?_{△}^{濃硫酸}$HCOOCH3+H2O;
(2)酯化反應中濃硫酸起到催化劑的作用,甲酸甲酯不溶于飽和碳酸鈉,且碳酸鈉可與甲酸反應,甲醇易溶于水,便于分層,所以飽和碳酸鈉的作用為中和揮發出來的甲酸,使之轉化為甲酸鈉溶于水中,溶解揮發出來的甲醇,降低甲酸甲酯在水中的溶解度,便于分層得到酯,
故答案為:催化;中和揮發出來的甲酸,使之轉化為甲酸鈉溶于水中,溶解揮發出來的甲醇,降低甲酸甲酯在水中的溶解度,便于分層得到酯;
(3)乙裝置中長導管C的作用是冷凝回流甲醇,平衡內外大氣壓強;冷凝管應從下口進水,上口出水,以保證水充滿冷凝管,起到充分冷凝的作用,
故答案為:冷凝回流甲醇,平衡內外大氣壓強;b;
(4)甲醇是有毒的易揮發的有機物,需要良好的冷凝效果,所以選擇乙,因為甲醇有毒,減少大氣污染,
故答案為:乙.
點評 本題考查物質的制備,側重于學生的分析、實驗以及計算能力的考查,注意把握有機物反應的特點以及常見儀器的使用,把握實驗的原理和操作方法,難度不大.


 優等生題庫系列答案
優等生題庫系列答案 53天天練系列答案
53天天練系列答案科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 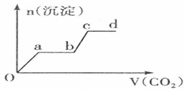 | B. | 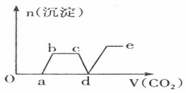 | ||
| C. | 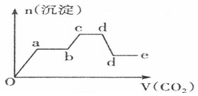 | D. |  |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 可用圖示裝置制取少量乙酸乙酯(酒精燈等在圖中均已略去).請填空:
可用圖示裝置制取少量乙酸乙酯(酒精燈等在圖中均已略去).請填空:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 項目 | 氨堿法 | 聯合制堿法 |
| A. | 原料 | 食鹽、氨氣、生石灰 | 食鹽、氨氣、二氧化碳 |
| B. | 可能的副產物 | 氯化鈣 | 氯化銨 |
| C. | 循環物質 | 氨氣、二氧化碳 | 氨氣、氯化鈉 |
| D. | 評價 | 原料易得、產率高 | 設備簡單、能耗低 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
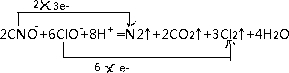 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com