
【題目】硫酸銨是化工、染織、醫藥、皮革等工業原料。某硫酸工廠利用副產品Y處理尾氣SO2得到CaSO4,再與相鄰的合成氨工廠聯合制備(NH4)2SO4,工藝流程如下:
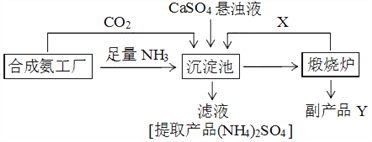
請回答以下問題:
(1)下列有關(NH4)2SO4溶液的說法正確的是_____
A.電離方程式:(NH4)2SO4![]() 2NH4++SO42-
2NH4++SO42-
B.水解離子方程式:NH4++H2O![]() NH3H2O+H+
NH3H2O+H+
C.離子濃度關系:c(NH4+)+c(H+)=c(SO42-)+c(OH–)
D.微粒濃度大小:c(NH4+)>c(SO42-)>c(H+)>c(NH3H2O)>c(OH–)
(2)硫酸工業中,V2O5作催化劑時發生反應2SO2+ O2 ![]() 2SO3,SO2的轉化率與溫度、壓強有關,請根據下表信息,結合工業生產實際,選擇下表中最合適的溫度和壓強分別是__________。該反應420℃時的平衡常數_____520℃時的平衡常數(填“>”、“<”或“=”)。
2SO3,SO2的轉化率與溫度、壓強有關,請根據下表信息,結合工業生產實際,選擇下表中最合適的溫度和壓強分別是__________。該反應420℃時的平衡常數_____520℃時的平衡常數(填“>”、“<”或“=”)。
| 1.01×105Pa | 5.05×105Pa | 1.01×106Pa |
420℃ | 0.9961 | 0.9972 | 0.9984 |
520℃ | 0.9675 | 0.9767 | 0.9852 |
620℃ | 0.8520 | 0.8897 | 0.9276 |
(3)在2L密閉容器中模擬接觸法制備三氧化硫時,若第12分鐘恰好達到平衡,測得生成SO3的物質的量為1.2mol,計算前12分鐘用氧氣表示反應速率v(O2)為___________。
(4)副產品Y是__。沉淀池中發生的主要反應方程式是___________________。
(5)從綠色化學和資源綜合利用的角度說明上述流程的主要優點是________________。
【答案】 BD 420℃、1.01×105Pa > 0.025mol/(L.min) 氧化鈣 CaSO4+CO2+2NH3+H2O==CaCO3↓+(NH4)2SO4 產生的CO2循環使用,物質充分利用,副產品有用,無污染性物質產生
【解析】本題分析:本題主要考查對于“工業制備(NH4)2SO4的工藝流程”的評價,涉及硫酸銨的水解等。
(1)A.(NH4)2SO4是強電解質,要用等號表示電離方程式,故A錯誤;B.正確;C.SO42-帶2個單位負電荷,離子的電荷濃度關系:c(NH4+)+ c(H+ ) = 2c(SO42- ) +c(OH–),故C錯誤; D. NH4+的水解程度小,從(NH4)2SO4的組成可以看出:c(NH4+) >c(SO42-)。溶液中的變化:H2O![]() H++OH-,
H++OH-,![]() +H2O
+H2O![]() NH3 ·H2O+H+,所以 c(H+) > c(NH3H2O )>c(OH–) 。總之,c(NH4+) >c(SO42-) > c(H+) > c(NH3H2O )>c(OH–),故D正確。故選BD。
NH3 ·H2O+H+,所以 c(H+) > c(NH3H2O )>c(OH–) 。總之,c(NH4+) >c(SO42-) > c(H+) > c(NH3H2O )>c(OH–),故D正確。故選BD。
(2)在420℃、1.01×105Pa時,轉化率已相當高,沒有必要加壓,所以最合適的溫度和壓強分別是420℃、1.01×105Pa。該反應升溫平衡左移,所以420℃時的平衡常數大于520℃時的平衡常數。
(3)v(SO3)=(1.2/12/2) mol/(L.min)= 0.05mol/(L.min), v(O2)= v(SO3)/2=0.025mol/(L.min)。
(4)副產品Y是氧化鈣。沉淀池中發生的主要反應的化學方程式是CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4。
(5)從綠色化學和資源綜合利用的角度,上述流程的主要優點是產生的CO2循環使用,物質充分利用,副產品有用,無污染性物質產生。


科目:高中化學 來源: 題型:
【題目】500 mL含有MgCl2、NaCl、Na2SO4三種物質的混合溶液,已知其中含有Cl為1.8 mol,Na+為2 mol,Mg2+為0.5 mol,則![]() 的物質的量濃度為
的物質的量濃度為
A.0.6 mol /L B.0.7 mol /L C.1.2 mol /L D.1.0 mol /L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將純鋅片和純銅片按圖示方式插入同濃度的稀硫酸中一段時間,以下敘述正確的是

A. 兩燒杯中銅片表面均無氣泡產生
B. 甲中銅片是正極,乙中銅片是負極
C. 兩燒杯中溶液的pH均增大
D. 生成氫氣的速率甲比乙慢
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某一反應物的物質的量是2.0mol,經過4min后,它的物質的量變成了1.68mol,則在這4min內它的反應速率是( )
A. 無法確定 B. 0.08 molL﹣1min﹣1
C. 0.32 molL﹣1min﹣1 D. 0.06 molL﹣1min﹣1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1.06g某有機物A完全燃燒后,得到1.792 L CO2氣體(標況)和0.9gH2O,該有機物對氫氣相對密度是53。(第(1)1分(2)(3)各2分共5分)
(1)求該有機物的相對分子質量。
(2)求該有機物的分子式
(3)根據下述實驗現象及結論是,確定該有機物的結構簡式
①它不能與溴發生反應
②它能使KMnO4酸性溶液褪色
③它能發生硝化反應,當引入1個硝基時,只能得到1種硝基化合物。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于膠體的說法正確的是
A. 直徑介于1~100納米之間的微粒稱為膠體
B. 當光束通過膠體時,看到的“光柱”是由于光被膠體粒子散射而形成的
C. 膠體的分散質不能透過濾紙的孔隙
D. 溶液是電中性的,膠體是帶電的
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由丙烯經下列反應可得到F、G兩種高分子化合物,它們都是常用的塑料。

(1)聚合物F的結構簡式是____________。
(2)D的結構簡式是________________。
(3)B轉化為C的化學方程式是_____________________。
(4)在一定條件下,兩分子E能脫去兩分子水形成一種六元環化合物,該化合物的結構簡式是_____________________________________。
(5)E有多種同分異構體,其中一種能發生銀鏡反應,1mol該種同分異構體與足量的金屬鈉反應產生1mol H2,則該種同分異構體為_____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖甲是一種利用微生物將廢水中的尿素(K2NCONH2)的化學能直接轉化為電能,并生成對環境無害物質的裝罝;同時利用此裝置的電能在鐵上鍍銅,下列說法中正確的是

A. H+透過質子交換膜由右向左移動
B. 銅電極應與X相連接
C. M電極反應式:H2NCONH2+H2O-6e-== CO2↑+N2↑+6H+
D. 當N電極消耗0.25 mol氣體時,鐵電極增重16 g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現需要0.2 mol·L1CuSO4溶液250 mL,實驗室除蒸餾水外還提供藍色膽礬晶體(CuSO4·5H2O)和4 mol·L1CuSO4溶液兩種試劑以配制該溶液。
(1)無論采用何種試劑進行配制,除燒杯、玻璃棒、膠頭滴管外,至少還必須用到的一種玻璃儀器是___________,在使用該儀器前必須進行的操作是______________________。
(2)若用膽礬晶體進行配制,需用托盤天平稱取CuSO4·5H2O的質量為___________ g;如果用4 mol/L的CuSO4溶液稀釋配制,需用量筒量取___________mL 4 mol/LCuSO4溶液。
(3)用4 mol/L的硫酸銅溶液稀釋配制溶液所需的實驗步驟有:
a.往燒杯中加入約100 mL水進行初步稀釋,冷卻至室溫
b.用量筒量取一定體積4 mol/L的硫酸銅溶液于一燒杯中
c.計算所需4 mol/L硫酸銅溶液的體積
d.蓋好瓶塞,反復上下顛倒搖勻后,將溶液轉存于試劑瓶中
e.加水至液面離容量瓶刻度線1~2 cm處改用膠頭滴管進行定容
f. 洗滌燒杯和玻璃棒2~3次并將洗滌液注入容量瓶,輕輕搖動容量瓶,使溶液混合均勻
g. 將溶液轉移入容量瓶
其中正確的操作順序為______________________。
(4)指出配制過程中的以下情形對所得溶液濃度的影響(填“偏高”“偏低”或“無影響”)。
①d步驟搖勻后,發現液面低于刻度線,再加水至刻度線:___________。
②e步驟中,俯視刻度線:___________。
③g步驟前,容量瓶未干燥,有少量蒸餾水:___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com