
| A. | 1:8 | B. | 8:1 | C. | 2:5 | D. | 5:2 |
分析 在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反應中,Mn元素化合價降低,被還原,Cl元素化合價升高,被氧化,KMnO4為氧化劑,HCl為還原劑,結合化合價的變化解答該題.
解答 解:在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反應中,Mn元素化合價降低,被還原,Cl元素化合價升高,被氧化,KMnO4為氧化劑,HCl為還原劑,Cl2為氧化產物,MnCl2為還原產物,當有2molKMnO4參加反應時,有10molHCl被氧化,則氧化劑與還原劑的物質的量之比為1:5,氧化劑與氧化產物物質的量之比為2:5,
故選C.
點評 本題考查氧化還原反應,題目難度不大,注意根據元素化合價的變化結合反應的化學方程式的計量數進行判斷.


科目:高中化學 來源: 題型:選擇題
| A. | 達到化學平衡時,正反應速率與逆反應速率不相等 | |
| B. | 反應過程中,Y的單質的體積分數始終為50% | |
| C. | 達到化學平衡時,X、Y的兩種單質在混合氣體中的物質的量之比為1:1 | |
| D. | 達到化學平衡的過程中,混合氣體平均相對分子質量逐漸減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
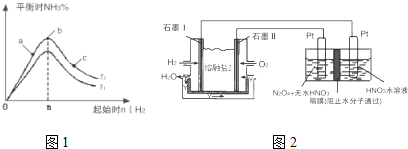
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 溫度( oC) | 15.0 | 25.0 | 30.0 | 35.0 |
| K/(×10-8 mol3•L-3) | 0.205 | 1.64 | 4.68 | 10.8 |
| A. | 若Z的體積分數不再隨時間變化時表示反應達平衡狀態 | |
| B. | 35 oC時,達平衡時,X分解了 0.03 mol | |
| C. | 該反應在高溫下可能自發 | |
| D. | 若在恒溫下,壓縮容器體積,再次達平衡后,n(X)比原平衡大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
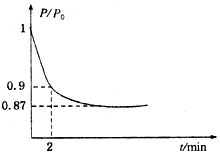 能源的開發利用與人類社會的可持續性發展息息相關.
能源的開發利用與人類社會的可持續性發展息息相關.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
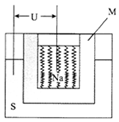 如圖是一種鈉硫高能電池的結構示意圖,M由Na2O和Al2O3制得,其作用是導電和隔膜,該電池反應為2Na+xS=Na2Sx.該電池正極的電極反應式為xS+2e-=Sx2-.
如圖是一種鈉硫高能電池的結構示意圖,M由Na2O和Al2O3制得,其作用是導電和隔膜,該電池反應為2Na+xS=Na2Sx.該電池正極的電極反應式為xS+2e-=Sx2-.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯與苯都能使溴水褪色,但褪色原理不同 | |
| B. | 1 mol乙烯與Cl2完全加成,然后與Cl2發生取代反應,共消耗氯氣5mol | |
| C. | 溴水遇到乙醛溶液出現褪色現象,是因為它們發生了氧化反應 | |
| D. | 二氯甲烷存在兩種不同的結構 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用敞口容器稱量NaOH且時間過長 | |
| B. | 定容時俯視讀取刻度 | |
| C. | 原容量瓶洗凈后未干燥 | |
| D. | 配制過程中,未用蒸餾水洗滌燒杯和玻璃棒 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com