
 (1)1.00g CH4完全燃燒生成液態水和CO2,放出55.6kJ熱量,寫出表示CH4的燃燒熱的熱化學方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1.
(1)1.00g CH4完全燃燒生成液態水和CO2,放出55.6kJ熱量,寫出表示CH4的燃燒熱的熱化學方程式CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1.分析 (1)燃燒熱是指在25℃、101kPa下,1mol純凈物完全燃燒生成穩定的氧化物放出的熱量,表示燃燒熱的熱化學方程式中可燃物的物質的量必須為1mol,產物必須為穩定氧化物;
(2)①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH4Fe(SO4)2先不考慮水解,則①(NH4)2CO3含有兩個NH4+,所以它們NH4+的濃度大于其它三種物質,溶液中c(NH4+)根據鹽類水解的影響分析判斷;
(3)①飽和的FeCl3溶液滴入沸水中反應生成氫氧化鐵膠體;
②碳酸氫鈉溶液中存在電離是碳酸氫鈉完全電離,碳酸氫根離子部分電離;
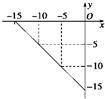
(4)①圖中數據計算離子積常數=c(H+).c(OH-),根據離子積常數計算氫離子濃度,進而求pH;
②設出氫氧化鋇溶液、鹽酸溶液的體積,然后根據溶液的pH列式計算出二者的體積比.
解答 解:(1)1g CH4完全燃燒生成液態水和CO2氣體,放出55.6kJ的熱量,則1mol即16g CH4完全燃燒生成液態水和CO2氣體,16×55.6kJ=889.6kJ,則甲烷燃燒熱的熱化學方程式為:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1,
故答案為:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-889.6KJ•mol-1;
(2)物質的量濃度相同的下列溶液:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH4Fe(SO4)2;先不考慮水解,則(NH4)2CO3 中含有兩個NH4+,所以它們NH4+的濃度大于其它三種物質,②④二種物質中,④NH4Fe(SO4)2酸性最強,NH4+水解受到的抑制最大,即NH4+的量較多,溶液中c(NH4+)較大,
①NH4Cl,NH4+水解,②NH4HCO3,碳酸氫根離子的水解對銨根離子起促進作用,即溶液中c(NH4+)④>③>②;
按c(NH4+)由大到小的順序排列為:①>④>③>②,
故答案為:①④③②;
(3)①飽和的FeCl3溶液滴入沸水中反應生成氫氧化鐵膠體 的離子方程式為:Fe3++3 H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(膠體)+3H+,
故答案為:Fe3++3 H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(膠體)+3H+;
②碳酸氫鈉溶液中存在電離是碳酸氫鈉完全電離,碳酸氫根離子部分電離;電離方程式為:NaHCO3=HCO3-+Na+,HCO3-?CO32-+H+,
故答案為:NaHCO3=HCO3-+Na+,HCO3-?CO32-+H+;
(4)①根據圖知,當c(H+)=10-5 mol/L,c(OH-)=10-10 mol/L,由離子積常數=c(H+).c(OH-)=10-5×10-10=10-15,
中性溶液中,c(H+)=c(OH-)=$\sqrt{1{0}^{-15}}$=10-7.5,pH=-lg10-7.5=7.5,
故答案為:7.5;
②設氫氧化鋇容溶液的體積為xL,鹽酸的體積為y,pH=8的Ba(OH)2溶液,溶液中c(OH-)=1×10-7mol/L,
pH=6的稀鹽酸溶液中c(H+)=1×10-6mol/L,
欲使混合溶液pH=7<7.5,溶液此時顯酸性,即混合后c(H+)=1×10-7mol/L,即$\frac{1{0}^{-6}y-1{0}^{-7}x}{x+y}$=1×10-5mol/L,解得x:y=9:2,
故答案為:9:2.
點評 本題考查鹽類水解的原理和應用,水的電離平衡分析,離子積常數的計算應用,注意離子積是一定溫度下的常數,隨溫度改變,鹽類水解的實質和把握弱電解質的電離,從影響平衡移動的角度分析離子濃度的大小比較是解答的關鍵,題目難度中等.


 勵耘書業暑假銜接寧波出版社系列答案
勵耘書業暑假銜接寧波出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 1L0.1mol/LCH3COOH溶液中含有0.1NA個氫離子 | |
| B. | 25℃是PH=13的Ba(OH)2溶液中含有0.1NA個OH- | |
| C. | 8.4gNaHCO3固體中含有0.1NA 個CO32- | |
| D. | 25℃,PH=11的Na2CO3溶液1L中由水電離出的H+的數目為10-3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題


查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 疊氮化物是一類重要化合物,氫疊氮酸(HN3)是一種弱酸,如圖1為分子立體結構示意圖.肼(N2H4)被亞硝酸氧化時便可生成氫疊氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性類似于醋酸,可微弱電離出H+和N${\;}_{3}^{-}$.試回答下列問題:
疊氮化物是一類重要化合物,氫疊氮酸(HN3)是一種弱酸,如圖1為分子立體結構示意圖.肼(N2H4)被亞硝酸氧化時便可生成氫疊氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性類似于醋酸,可微弱電離出H+和N${\;}_{3}^{-}$.試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某校高一化學研究性學習小組對日常生活中的氯氣用途進行了調查,了解到氯氣可廣泛地應用于衣物的漂白、水體的殺菌和消毒等.
某校高一化學研究性學習小組對日常生活中的氯氣用途進行了調查,了解到氯氣可廣泛地應用于衣物的漂白、水體的殺菌和消毒等.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com