
鐵及其化合物與生產、生活關系密切。
(1)下圖是實驗室研究海水對鐵閘不同部位腐蝕情況的剖面示意圖。
①該電化腐蝕稱為 。
②圖中A和B區域相比較,腐蝕較慢的是 (填字母)。
(2)實驗室經常用到FeCl3溶液,在配制FeCl3溶液時常需加入少量 的 ;將FeCl3溶液和碳酸氫鈉溶液混合,將產生紅褐色沉淀和無色氣體,該反應的離子方程式為 。
(3)已知t℃時,反應FeO(s)+CO(g) Fe( s) +CO2(g)的平衡常數K= 0.25。
Fe( s) +CO2(g)的平衡常數K= 0.25。
①t℃時,反應達到平衡時n(CO2):n(CO)=
②若在1L密閉容器中加人0.02 mol FeO(s),并通入x mol CO,t℃時反應達到平衡。此時
FeO(s)轉化率為50%,則x= 。
(1)吸氧腐蝕 A (2) 鹽酸 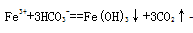 (3)4;1 0.05
(3)4;1 0.05
解析試題分析:B中接觸了水和氧氣,更加容易被腐蝕,制備氯化鐵加入鹽酸主要是防止氯化鐵發生水解。衡常數是指在一定溫度下,當一個可逆反應達到化學平衡時,生成物濃度冪之積與反應物濃度冪之積的比值,
但需要注意但是固體和純液體的濃度視為常數,不能出現在表達式中,c(CO2) c(CO)
則K=
所以n(CO2):n(CO)=1;4
(3)由于FeO(s)轉化率為50%即參與反應的FeO為0.01摩爾,則消耗0.01摩爾一氧化碳,生成0.01摩爾的二氧化碳。所以在 平衡時,氧化亞鐵的量為0.01、一氧化碳為X-0.01摩爾,二氧化碳為0.01摩爾,據化學平衡常數計算公式可得0.04=X—0.01即X=0.05摩爾
考點:化學平衡的計算的相關知識點的應用


科目:高中化學 來源: 題型:單選題
在一定條件下,將 兩種氣體通入密閉容器中,反應按
兩種氣體通入密閉容器中,反應按

 進行,2秒鐘后反應速率如下:
進行,2秒鐘后反應速率如下: ,
, ,
, ,則x、y的值分別為( )
,則x、y的值分別為( )
| A.3和2 | B.1和3 | C.3和1 | D.4和5 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(10分) )氮元素有著多變價態和種類繁多的化合物,因在生產、生活中發揮著重要的作用。完成下列問題:
(1)在一密閉容器中,進行如下化學反應:
N2(g)+3H2(g) 2NH3(g) △H<0,其化學平衡常數K與溫度T的關系如下表:
2NH3(g) △H<0,其化學平衡常數K與溫度T的關系如下表:
| T | 298 K | 398 K | 498 K | … |
| K | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(11分)
(1)在一密閉的2 L的容器里充入8 mol SO2和4 mol18O2,在一定條件下開始反應:
2SO2(g)+O2(g) 2SO3(g)2 min末測得容器中有7.2 mol SO2。試回答:
2SO3(g)2 min末測得容器中有7.2 mol SO2。試回答:
①反應后18O原子存在于哪些物質中________
②2 min末SO3的濃度為________
③用O2的濃度變化表示該時間段內的化學反應速率為________
(2)基本化工原料苯和乙烯,都有著十分廣泛的用途。請回答:
①可以用來鑒別苯蒸氣和乙烯的試劑是________(填序號)
A.水 B.溴的四氯化碳溶液 C.酸性高錳酸鉀溶液 D.氫氣
②苯分子具有平面正六邊形結構,所有原子共平面,則苯分子中在一條直線上的原子最多有________個
(3)下列營養物質在人體內發生的變化及其對人的生命活動所起的作用不正確的是
A.人體中的糖類、油脂和蛋白質都能為人的生命活動提供能量
B.淀粉和纖維素 葡萄糖
葡萄糖 CO2和H2O(釋放能量維持生命活動)
CO2和H2O(釋放能量維持生命活動)
C.油脂 甘油和高級脂肪酸
甘油和高級脂肪酸 CO2和H2O(釋放能量維持生命活動)
CO2和H2O(釋放能量維持生命活動)
D.蛋白質 氨基酸
氨基酸 人體所需的蛋白質(人體生長發育、新陳代謝)
人體所需的蛋白質(人體生長發育、新陳代謝)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(5分)在固定容積的密閉容器中,有可逆反應nA(g)+mB(g)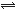 pC(g)處于平衡狀態(已知n+m>p,△H>0)。升高溫度時c(B)/c(C)的比值 ,混合氣體的密度 ;降溫時,混合氣體的平均相對分子質量 ;加入催化劑,氣體的總物質的量 ;充入C,則A、B的物質的量 。(填增大、減小、不變、不確定)
pC(g)處于平衡狀態(已知n+m>p,△H>0)。升高溫度時c(B)/c(C)的比值 ,混合氣體的密度 ;降溫時,混合氣體的平均相對分子質量 ;加入催化劑,氣體的總物質的量 ;充入C,則A、B的物質的量 。(填增大、減小、不變、不確定)
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(12分)科學家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理為:N2(g)+3H2(g)  2NH3(g)
2NH3(g)  H="-92.4" kJ/mol,該反應的能量變化如圖所示。
H="-92.4" kJ/mol,該反應的能量變化如圖所示。
①在反應體系中加入催化劑,反應速率增大,E2的變化是 (填“增大”、“減小”或“不變”)。
②將0.3 mol N2和0.5 mol H2充入體積不變的密閉容器中,在一定條件下達到平衡,測得容器內氣體壓強變為原來的 ,此時H2的轉化率為 (計算出結果);欲提高該容器中H2的轉化率,下列措施可行的是 (填選項字母)。
,此時H2的轉化率為 (計算出結果);欲提高該容器中H2的轉化率,下列措施可行的是 (填選項字母)。
| A.向容器中按原比例再充入原料氣 | B.向容器中再充入一定量H2 |
| C.改變反應的催化劑 | D.液化生成物分離出氨 |
 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H="+1530" kJ/mol
H="+1530" kJ/mol H="+44.0" kJ/mol
H="+44.0" kJ/mol 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H = kJ/mol,該反應的化學平衡常數表達式為K= ,控制其他條件不變,增大壓強,K值 (填“增大”、“減小”或“不變”)。
H = kJ/mol,該反應的化學平衡常數表達式為K= ,控制其他條件不變,增大壓強,K值 (填“增大”、“減小”或“不變”)。查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(18分)能源的開發和利用是當前科學研究的重要課題。
(1)利用二氧化鈰(CeO2)在太陽能作用下前實現如下變廢為寶的過程:
mCeO2 (m-x)CeO2
(m-x)CeO2 xCe+xO2
xCe+xO2
(m-x)CeO2 xCe+xH2O+xCO2
xCe+xH2O+xCO2 mCeO2+xH2+xCO
mCeO2+xH2+xCO
上述過程的總反應是 ,該反應將太陽能轉化為 。
(2)CO、O2和KOH溶液構成的燃料電池的負極電極反應式為 。該電池反應可獲得K2CO3溶液,某溫度下0.5mol L-1 K2CO3溶液的pH=12,若忽略CO32-的第二級水解,則CO32- +H2O
L-1 K2CO3溶液的pH=12,若忽略CO32-的第二級水解,則CO32- +H2O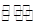 HCO3-+OH-的平衡常熟Kh= 。
HCO3-+OH-的平衡常熟Kh= 。
(3)氯堿工業是高耗能產業,下列將電解池與燃料電池相組合的工藝可以節能30%以上。
①電解過程中發生反應的離子方程式是 ,陰極附近溶液PH (填“不變”、“升高”或“下降”)。
②如果粗鹽中SO42-含量較高,精制過程需添加鋇試劑除去SO42-,該鋇試劑可選用下列試劑中的 。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
現代工藝中更多使用BaCO3除SO42-,請寫出發生反應的離子方程式 。
③圖中氫氧化鈉溶液的質量分數a% b%(填“>”、‘‘=”或“<”),,燃料電池中負極上發生的電極反應為 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(15分)鐵及其化合物與生產、生活關系密切。
(1)下圖是實驗室研究海水對鐵閘不同部位腐蝕情況的剖面示意圖。
①該電化腐蝕稱為 。
②圖中A、B、C、D四個區域,生成鐵銹最多的是 (填字母)。
(2)用廢鐵皮制取鐵紅(Fe2O3)的部分流程示意圖如下:
①步驟I若溫度過高,將導致硝酸分解。硝酸分解的化學方程式為 。
②步驟Ⅱ中發生反應:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反應產生的HNO3又將廢鐵皮中的鐵轉化為Fe(NO3)2,該反應的化學方程式為 。
③上述生產流程中,能體現“綠色化學”思想的是 (任寫一項)。
(3)已知t℃時,反應FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常數K=0.25。
Fe(s)+CO2(g)的平衡常數K=0.25。
①t℃時,反應達到平衡時n(CO):n(CO2)= 。
②若在1 L密閉容器中加入0.02 mol FeO(s),并通入xmolCO,t℃時反應達到平衡。此時FeO(s)轉化率為50%,則x= 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(17分)氮化硅是一種新型陶瓷材料,它可由石英晶體與焦炭顆粒在高溫的氮氣流中,通過如下反應制得:3SiO2 + 6C + 2N2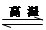 Si3N4 + 6CO,該反應過程中的能量變化如圖⑵所示;回答下列問題:
Si3N4 + 6CO,該反應過程中的能量變化如圖⑵所示;回答下列問題: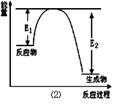
(1)上述反應中的還原劑是 ,還原產物是 。
(2)該反應是 (填“吸熱”或“放熱”)反應。
(3)在一定溫度下,上述反應在4L密閉容器內進行,用M、N兩種物質描述其物質的量隨時間變化的曲線如圖⑶所示: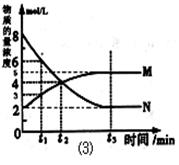
①M、N表示的物質分別為 、 。
②比較t2時刻,正逆反應速率大小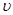 (正)
(正) 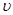 (逆)。
(逆)。
(填“>”、“=”、“<”)。.
③若t2=2min,計算反應開始至t2時刻,M的平均化學反應速率為 。
④t3時刻化學反應達到平衡時反應物的轉化率為 。
(4)①某種氫燃料電池是用固體金屬氧化物陶瓷作電解質,某電極上發生的電極反應為:A極H2-2e-+O2-===H2O;則A極是電池的 極 (填“正”或“負”)。
②上述合成氮化硅的反應產生的尾氣不能排放,經過處理以后可以用下圖所示的儀器測量尾氣中CO的含量。多孔電極中間的固體氧化鋯—氧化釔為電解質,這種固體電解質允許O2-在其間通過,其工作原理如圖⑷所示,其中多孔Pt電極a、b分別是氣體CO、O2的載體。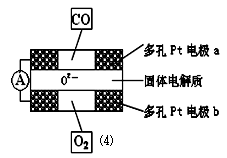
Ⅰ.該電池的正極為 (填a或b);O2 流向 (填 “正極”或“負極”)
Ⅱ.該電池的正極反應式為 ,負極反應式為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com