
 Na2S2O3、Na2S、Na2SO3等含硫化合物在工業上有廣泛的用途.
Na2S2O3、Na2S、Na2SO3等含硫化合物在工業上有廣泛的用途.分析 (1)Na2S2O3+H2SO4(稀)→Na2SO4+S↓+SO2↑+H2O該反應化合價降低的、升高的都是硫元素,屬于氧化還原反應中的歧化反應,據此解答;
(2)反應中S2O32-中的硫由+2價升高到硫酸根離子中的+6價,氯氣中的氯元素由0價降低到-1價的氯離子,依據氧化還原反應得失電子守恒結合原子個數守恒規律配平方程式;依據S2O32-~2SO42-~8e-計算轉移電子數目;
(3)依據亞硫酸鈉為強電解質,完全電離,亞硫酸根離子為多元弱酸根離子,部分發生水解生成亞硫酸氫根離子和氫氧根離子,亞硫酸氫根離子繼續水解生成硫離子和氫氧根離子結合水的電離,排序;
(4)Na2S溶液顯堿性是因為硫化鈉為強堿弱酸鹽,水解生成氫氧化鈉和硫氫化鈉,硫化銅溶解度小于硫化鋅,能夠實現沉淀的轉化.
解答 解:(1)Na2S2O3+H2SO4(稀)→Na2SO4+S↓+SO2↑+H2O氧化劑還原劑都是Na2S2O3,Na2S2O3中硫元素化合價部分升高,部分降低,屬于氧化還原反應中歧化反應,
a.2H2S+SO2→3S↓+2H2O,硫化氫做還原劑,二氧化硫做氧化劑,屬于歸中反應,故不選;
b.3NaClO $\stackrel{△}{→}$ 2NaCl+NaClO3,氧化劑還原劑都是NaClO,其中的氯元素部分化合價升高,部分降低屬于歧化反應,故選;
c.S+2H2SO4(濃)$\stackrel{△}{→}$ 3SO2↑+2H2O,硫做還原劑,濃硫酸做氧化劑,不屬于歧化反應,故不選;
d.4P+3NaOH+3H2O→3NaH2PO2+PH3,氧化劑還原劑都是P,其中的P元素部分化合價升高,部分降低屬于歧化反應,故選;
故選:bd;
(2)由給出方程式可知:反應中S2O32-中的硫由+2價升高到硫酸根離子中的+6價,氯氣中的氯元素由0價降低到-1價的氯離子,依據氧化還原反應得失電子守恒,S2O32-系數為1,Cl2系數為4,依據原子個數守恒,反應方程式為:1S2O32-+4Cl2+5H2O→2SO42-+8Cl-+10H+;
若反應中生成0.2mol SO42-,依據S2O32-~2SO42-~8e-,可知轉移電子數目為0.8mol;
故答案為:1、4、5H2O、2、8、10;0.8;
(3)亞硫酸鈉雖然能水解,但程度不大,所以主要離子為鈉離子和亞硫酸根離子,由于HSO3-還能少量水解,故氫氧根離子濃度略大于HSO3-,由于溶液呈堿性,所以H+是最小的,所以離子濃度大小關系為:[Na+]>[SO32-]>[OH-]>[HSO3-]>[H+],②是SO32-,④是HSO3-;
故答案為:SO32-,HSO3-;
(4)知Na2S溶液顯堿性,其主要原因是硫離子水解,離子方程式:S2-+H2O HS-+OH-;
硫化銅溶解度小于硫化鋅,往裝有Na2S溶液的燒杯中加入足量的ZnCl2溶液,產生白色的ZnS沉淀;再向燒杯中滴加CuCl2溶液,沉淀轉變為黑色,是因為Cu2+與S2-離子能生成更難溶于水的CuS,使平衡ZnS(s)?Zn2++S2-向右移動;
故答案為:S2-+H2O?HS-+OH-;Cu2+與S2-離子能生成更難溶于水的CuS,使平衡ZnS(s)?Zn2++S2-向右移動.
點評 本題考查了氧化還原反應規律及方程式書寫,鹽類水解規律、離子濃度大小比較,沉淀溶解平衡移動,熟悉鹽類水解規律和溶度積規則是解題關鍵,題目難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 9種 | B. | 16種 | C. | 32種 | D. | 64種 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 6.4g由S2、S4、S8組成的混合物中所含硫原子數為0.2NA | |
| B. | 用100ml 4mol/L鹽酸與8.7g MnO2供熱能制取氯氣4.48L | |
| C. | 一定溫度下,0.1L 0.1mol/L的CH3COOH溶液和1L 0.01mol/L 的CH3COOH溶液所含CH3COO-的數目均為0.01NA | |
| D. | 一定條件下,將1mol N2和3 mol H2混合,充分反應后轉移的電子數為6 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
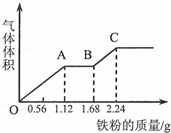 向100mL稀硫酸和稀硝酸的混合溶液中逐漸加入鐵粉,產生氣體的體積(相同狀況)隨鐵粉質量增加的變化如圖所示.下列分析錯誤的是.( )
向100mL稀硫酸和稀硝酸的混合溶液中逐漸加入鐵粉,產生氣體的體積(相同狀況)隨鐵粉質量增加的變化如圖所示.下列分析錯誤的是.( )| A. | 原混合酸溶液的pH=0,c(H2SO4)=0.1mol•L-1 | |
| B. | OA段的反應為:Fe+NO3-+4H+═Fe3++NO↑+2H2O | |
| C. | AB段的反應為:Fe+2Fe3+═3Fe2+ | |
| D. | BC段氣體產物為氫氣 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.3000 mol/L | B. | 1.2000 mol/L | C. | 0.0333 mol/L | D. | 0.1333 mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
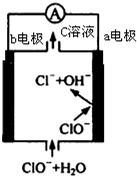 鎂-次氯酸鹽燃料電池的工作原理如圖,該電池反應為:Mg+ClO -+H2O═Mg(OH)2+Cl-下列有關說法正確的是( )
鎂-次氯酸鹽燃料電池的工作原理如圖,該電池反應為:Mg+ClO -+H2O═Mg(OH)2+Cl-下列有關說法正確的是( )| A. | 電池工作時,C溶液中的溶質是MgCl2 | |
| B. | 電池工作時,正極a附近的PH將不斷增大 | |
| C. | 負極反應式:ClO --2e -+H2O═Cl-+2 OH- | |
| D. | b電極發生還原反應,每轉移0.1mol電子,理論上生成0.1mol Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 科學家研制的航天推進劑-離子液體火箭推進劑AF-M315E,其主要成分是羥基硝酸銨,它比肼燃燒釋放能量更高,更安全、環保,預計最早將在今年進行衛星飛行試驗.羥基硝酸銨的結構如圖所示,下列說法不正確的是( )
科學家研制的航天推進劑-離子液體火箭推進劑AF-M315E,其主要成分是羥基硝酸銨,它比肼燃燒釋放能量更高,更安全、環保,預計最早將在今年進行衛星飛行試驗.羥基硝酸銨的結構如圖所示,下列說法不正確的是( )| A. | 羥基硝酸銨中陽離子的各原子共平面 | |
| B. | 羥基硝酸銨是離子化合物 | |
| C. | 羥基硝酸銨中含有離子鍵和共價鍵 | |
| D. | 9.6g羥基硝酸銨中含有0.2mol離子 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com