
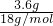 =0.2mol,即0.1mol混合烴完全燃燒生成0.16molCO2和0.2molH2O,根據元素守恒,則混合烴的平均分子式為C1.6H4,根據平均分子式進行判斷.
=0.2mol,即0.1mol混合烴完全燃燒生成0.16molCO2和0.2molH2O,根據元素守恒,則混合烴的平均分子式為C1.6H4,根據平均分子式進行判斷.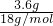 =0.2mol,即0.1mol混合烴完全燃燒生成0.16molCO2和0.2molH2O,根據元素守恒,則混合烴的平均分子式為C1.6H4.烴中C原子數小于1.6的只有甲烷,則一定含有甲烷,CH4分子中含4個氫原子,故另一種分子中一定含4個氫原子,且其碳原子數大于1.6,故可能是C2H4或C3H4,一定沒有C2H6或C2H2,二者的H原子不等于4,
=0.2mol,即0.1mol混合烴完全燃燒生成0.16molCO2和0.2molH2O,根據元素守恒,則混合烴的平均分子式為C1.6H4.烴中C原子數小于1.6的只有甲烷,則一定含有甲烷,CH4分子中含4個氫原子,故另一種分子中一定含4個氫原子,且其碳原子數大于1.6,故可能是C2H4或C3H4,一定沒有C2H6或C2H2,二者的H原子不等于4,

科目:高中化學 來源: 題型:
 兩種氣態烴組成的混合氣體,完全燃燒后得到CO2和H2O的物質的量隨著混合烴物質的量的變化如圖所示.則下列對混合烴的判斷正確的是( )
兩種氣態烴組成的混合氣體,完全燃燒后得到CO2和H2O的物質的量隨著混合烴物質的量的變化如圖所示.則下列對混合烴的判斷正確的是( )查看答案和解析>>
科目:高中化學 來源: 題型:
 兩種氣態烴組成的混合氣體,完全燃燒后得到CO2和H2O的物質的量隨著混合烴物質的量的變化如圖所示,則下列對混合烴的判斷正確的是( )
兩種氣態烴組成的混合氣體,完全燃燒后得到CO2和H2O的物質的量隨著混合烴物質的量的變化如圖所示,則下列對混合烴的判斷正確的是( )| A、②⑤⑥ | B、①②④ | C、④⑥ | D、②③ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com