

| A. | 該有機物與濃溴水可發生取代反應 | |
| B. | 1 mol該有機物與足量NaOH溶液反應最多消耗4 mol NaOH | |
| C. | 該有機物能與Na、Na2CO3、NaHCO3溶液發生反應 | |
| D. | 該有機物經催化氧化后與銀氨溶液水浴加熱,可生成光亮的銀鏡 |
分析 由結構簡式可知,分子中含酚-OH、-COOC-、-OH、-Br,結合酚、酯、醇、鹵代烴的性質來解答.
解答 解:A.含酚-OH,其鄰、對位可與濃溴水發生取代反應,故A正確;
B.酚-OH、-COOC-、-Br均與NaOH反應,且-COOC-水解生成的酚-OH也與NaOH反應,則1 mol該有機物與足量NaOH溶液反應最多消耗4 mol NaOH,故B正確;
C.只有酚羥基具有酸性,但酸性比碳酸弱,與NaHCO3溶液不反應,故C錯誤;
D.與-OH相連的C上有2個H,可催化氧化生成-CHO,可發生銀鏡反應,故D正確.
故選C.
點評 本題考查有機物的結構與性質,為高頻考點,把握官能團與性質的關系為解答的關鍵,側重酚、酯、醇、鹵代烴性質的考查,選項B為解答的易錯點,題目難度不大.


科目:高中化學 來源: 題型:解答題
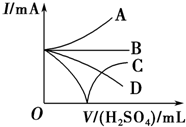 向Ba(OH)2溶液中加入稀硫酸,請完成下列問題:
向Ba(OH)2溶液中加入稀硫酸,請完成下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4 L H2O中含有的分子數為NA | |
| B. | 32g O2中含有的分子數為NA | |
| C. | 7.1gCl2與足量的氫氧化鈉溶液反應轉移的電子數一定為0.2NA | |
| D. | 1 L 1 mol•L-1 CaCl2溶液中含有的氯離子數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 第①步中除去粗鹽中的SO42-、Ca2+、Mg2+、Fe3+雜質,加入的藥品順序為:Na2CO3溶液→NaOH溶液→BaCl2溶液→過濾后加鹽酸 | |
| B. | 工業上金屬鈉是通過氯堿工業進行制取 | |
| C. | 第③步中結晶出的MgCl2•6H2O可在空氣中受熱分解制無水MgCl2 | |
| D. | 第④步中溴元素被氧化,第⑤步中既有溴元素被氧化也有溴元素被還原 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 有一澄清透明的溶液,可能有NH4+、Fe3+、H+、Mg2+、Al3+、I-、CO32-等離子,現分別取溶液進行下列實驗:
有一澄清透明的溶液,可能有NH4+、Fe3+、H+、Mg2+、Al3+、I-、CO32-等離子,現分別取溶液進行下列實驗:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
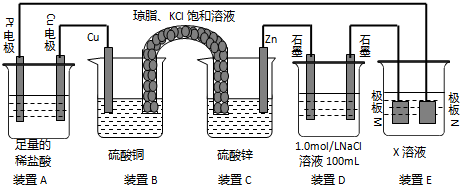
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 該反應的熱化學方程式為$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g)△H=-92kJ•mol-1 | |
| B. | 不用催化劑,生成1molNH3放出的熱量為46kJ,加入催化劑,生成1molNH3放出的熱量為小于46kJ | |
| C. | 加入催化劑,降低了正反應的活化能,升高了逆反應的活化能 | |
| D. | 在溫度、體積一定的條件下,通入1molN2和3molH2,反應后放出的熱量為Q1,若通入2molN2和6molH2,反應后放出的熱量為Q2,則Q1<0.5Q2<92KJ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
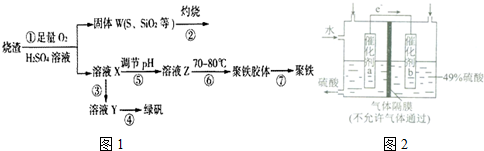
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com