
【題目】一定條件下,在水溶液中1 mol ClOx-(x=0,1,2,3,4)的能量(kJ)相對大小如圖所示,下列有關說法正確的是( )
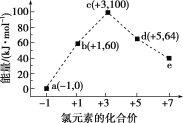
A.e是ClO3-
B.b→a+c反應的活化能為60 kJ·mol-1
C.a、b、c、d、e中c最穩定
D.b→a+d反應的熱化學方程式為3ClO-(aq)=2Cl-(aq)+ClO3-(aq) ΔH=-116 kJ·mol-1
【答案】D
【解析】
從圖中可知,各微粒中氯元素的化合價:a為-1價,b為+1價,c為+3價,d為+5價,e為+7價。根據氧化還原反應寫出b→a+c和b→a+d的離子反應方程式。
A選項,根據圖可知e對應的價態為+7價,因此該離子為ClO4-,故A錯誤;
B選項,b→a+c即2ClO-(aq)= Cl-(aq)+ClO2-(aq) ΔH=(100 kJ·mol-1+0 kJ·mol-1)2×60 kJ·mol-1 = 20 kJ·mol-1,該反應為放熱反應,但無法知道該反應的活化能,故B錯誤;
C選項,根據能量越低越穩定,a、b、c、d、e中a能量最低,所以a最穩定,故C錯誤;
D選項,b→a+d反應的熱化學方程式為3ClO-(aq)=2Cl-(aq)+ClO3-(aq) ΔH=(64kJ/mol+2×0kJ/mol)3×60kJ/mol=116kJ/mol,為放熱反應,反應物的鍵能之和小于生成物的鍵能之和,故D正確;
綜上所述,答案為D。


科目:高中化學 來源: 題型:
【題目】為了驗證濃硫酸和木炭粉在加熱條件下產生的氣體產物,某同學選用了如圖所示的實驗裝置。下列說法錯誤的是
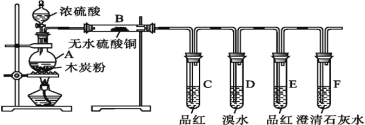
A.B裝置用來檢驗產物中是否有水蒸氣生成
B.C裝置用來檢驗產物中是否有SO2生成
C.D裝置中溴水褪色,則說明SO2具有漂白性
D.F裝置用來檢驗產物中是否有CO2生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用Cl2生產含氯有機物時會產生HCl。
利用反應__HCl(g)+__O2(g)__Cl2(g)+__H2O(g)可實現氯的循環利用。
完成下列填空:
(1)配平該化學方程式,并標出電子轉移的方向和數目。_____
(2)若將該反應設計成一原電池,則Cl2應在_____(填“正極”或“負極”)附近逸出。
(3)上述反應中所有元素原子半徑由大到小的順序為_____;與氯元素同族的短周期元素原子最外層電子排布式為____。
(4)判斷氯、溴非金屬性強弱的依據是____(選填序號)。
a.熔點:Cl2<Br2 b.氧化性:Cl2>Br2 c.熱穩定性:HCl>HBr d.酸性:HCl<HBr
(5)上述反應若在固定體積的密閉容器中發生,能說明反應已達平衡的是__(選填序號)。
a.2v(HCl)正=v(Cl2)逆 b.體系壓強不再改變
c.混合氣體密度不變 d.![]() =K
=K
(6)若反應容器容積為2L,4molHCl與1molO2混合氣體反應至8min時,測得容器內氣體壓強減小了10%,則用HCl表示的該反應的化學反應速率為___。
(7)圖是在4種不同投料比下,溫度對HCl平衡轉化率影響的曲線(![]() =1,2,4,6)
=1,2,4,6)

①曲線a對應的投料比![]() ____。
____。
②不改變投料比,使曲線b達到曲線d相同的HCl平衡轉化率,可采取的措施有____;____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)3﹣甲基﹣2﹣丙基﹣1﹣戊烯結構簡式為_____________;
(2)丙烯制備聚丙烯化學方程式:__________________;
(3)2-甲基-1,3-丁二烯與Br2的1,4-加成反應化學方程式__________________;
(4)![]() 名稱為:_____________;
名稱為:_____________;
(5)反-2-丁烯 ___________________________
(6)有機物A只由C,H,O三種元素組成,常用作有機合成的中間體,測得8.4g該有機物經燃燒生成22.0g CO2和7.2g水,質譜圖表明其相對分子質量為84;紅外光譜分析表明A中含有-O-H和位于分子端的C、H,核磁共振氫譜顯示有3種峰,且峰面積之比為6:1:1.
①寫出A的分子式___________;
②寫出A的結構簡式___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】![]() 為阿伏加德羅常數的值。下列說法正確的是( )
為阿伏加德羅常數的值。下列說法正確的是( )
A.![]() 標準狀況
標準狀況![]() 氦氣含有的質子數為
氦氣含有的質子數為![]()
B.1mol氯氣與足量的鐵反應,轉移電子數目為3NA
C.![]() 溶液中所含
溶液中所含![]() 的數目為
的數目為![]()
D.密閉容器中![]() 與
與![]() 充分反應,產物的分子數為
充分反應,產物的分子數為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A、B、C、D是中學化學中常見的四種不同粒子,它們之間存在如下圖所示的轉化關系:
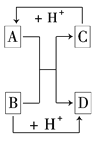
(1)如果A、B、C、D均是10電子的粒子,請寫出:
A的電子式_____________;D的電子式____________;
(2)如果A和C是18電子的粒子,B和D是10電子的粒子,請寫出:
①A與B在溶液中反應的離子方程式:____________________________________
②根據上述離子方程式,可判斷C與B結合質子的能力大小是(用化學式或離子符號表示)________>________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】北京奧運會祥云火炬的主要燃料為丙烷,下列關于丙烷的說法正確的是
A.丙烷分子中3個碳原子在一條直線上
B.丙烷可以與溴水發生取代反應
C.丙烷在空氣中燃燒只可能生成CO2和H2O
D.常溫常壓下,22g丙烷所含氫原子數為4NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】焦亞硫酸鈉(Na2S2O5)是常用的食品抗氧化劑之一。某研究小組進行如下實驗:
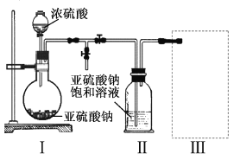
實驗一焦亞硫酸鈉的制取
采用如圖裝置(實驗前已除盡裝置內的空氣)制取Na2S2O5。裝置II中有Na2S2O5晶體析出,發生的反應為:
Na2SO3+SO2=Na2S2O5
(1)裝置I中產生氣體的化學方程式為 。
(2)要從裝置II中獲得已析出的晶體,可采取的分離方法是 。
(3)裝置III用于處理尾氣,可選用的最合理裝置(夾持儀器已略去)為 。(填序號)。
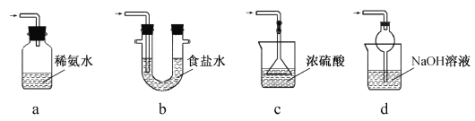
實驗二焦亞硫酸鈉的性質
Na2S2O5溶于水即生成NaHSO3。
(4)檢驗Na2S2O5晶體在空氣中已被氧化的實驗方案是 。
實驗三葡萄酒中抗氧化劑殘留量的測定
(5)葡萄酒常用Na2S2O5作抗氧化劑。測定某葡萄酒中抗氧化劑的殘留量(以游離SO2計算)的方案如下:

(已知:餾分中的二氧化硫在滴入碘水時發生的反應為
SO2+I2+2H2O=H2SO4+2HI)在測定時消耗了0.01mol·L-1的I2溶液25.00 mL,該次實驗測得樣品中抗氧化劑的殘留量(以游離SO2計算)為 g·L-1。在上述實驗過程中,若有部分HI被空氣氧化,則測得結果 (填“偏高”“偏低”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)下列五個反應
A.5Cl2+I2+6H2O=10HCl+2HIO3
B.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
C.2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O
D.2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
E.MnO2+4HCl![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
上述反應中氯元素只被氧化的是_____________,(填字母,下同)只被還原的是_____________,部分被氧化的是_____________,C中被氧化與被還原的物質的量之比為_____________。
(2)在反應4(NH4)2SO4![]() N2↑+6NH3↑+3SO2↑+SO3↑+7H2O中,氧化產物與還原產物的物質的量之比為___________,生成56gN2轉移的電子___________mol。
N2↑+6NH3↑+3SO2↑+SO3↑+7H2O中,氧化產物與還原產物的物質的量之比為___________,生成56gN2轉移的電子___________mol。
(3)飲用水中的NO3-對人類健康會產生危害,為了降低飲用水中NO3-的濃度,某飲用水研究人員提出,在堿性條件下用鋁粉將NO3-還原為N2,其化學方程式為:10A1+6NaNO3+4NaOH==10NaA1O2+3N2↑+2H2O。上述反應中,若產生2mol N2,轉移電子數為_________(用NA表示阿伏加德羅常數);用“雙線橋”表示反應中電子轉移,化合價的變化,反應類型:______________。
(4)將等質量的兩份鎂、鋁合金分別投入足量的NaOH和HCl中,在相同的情況下測得生成氣體的體積之比為1:2,求合金中鎂、鋁的物質的量之比為___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com