
【題目】A、B、C是中學化學常見的三種物質,它們之間的相互轉化關系如下(部分反應條件及產物略去). A ![]() B
B ![]() C
C
(1)若A是一種黃色單質固體,則B→C的化學方程式為 .
(2)若A是一種活潑金屬,C是淡黃色固體,試用化學方程式表示C與二氧化碳氣體的反應 . 將C長期露置于空氣中,最后將變成物質D,D的化學式為 . 現有D和NaHCO3的固體混合物10.0g,加熱至質量不再改變,剩余固體質量為9.38g,D的質量分數為 .
(3)若C是紅棕色氣體,如圖是實驗室制取A氣體的裝置,請結合所學知識,回答下列問題: 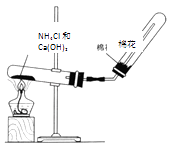
①試寫出由A到B的化學方程式 .
②驗證A是否已經收集滿的方法是(任寫一種).
③寫出工業上制取A的化學方程式 .
④C與水反應可得到酸X,要使1molC恰好完全轉化為X,需通入氧氣的物質的量為 .
【答案】
(1)2SO2+O2![]() 2SO3
2SO3
(2)2Na2O2+2CO2=2Na2CO3+O2↑; Na2CO3;83.2%
(3)4NH3+5O2![]() NO+6H2O;將濕潤的紅色石蕊試紙置于試管口處,若試紙變藍,則證明氨氣已收集滿(或用蘸有濃鹽酸的玻璃棒靠近試管口處,若產生大量白煙,則證明氨氣已收集滿); N2+3H2
NO+6H2O;將濕潤的紅色石蕊試紙置于試管口處,若試紙變藍,則證明氨氣已收集滿(或用蘸有濃鹽酸的玻璃棒靠近試管口處,若產生大量白煙,則證明氨氣已收集滿); N2+3H2![]() 2NH3;0.25mol
2NH3;0.25mol
【解析】解:(1)若A是一種黃色單質固體,則A是S單質,屬于B是二氧化硫,C是三氧化硫,則B→C的化學方程式為2SO2+O2 ![]() 2SO3,
2SO3,
所以答案是:2SO2+O2 ![]() 2SO3;(2)若A是一種活潑金屬,C是淡黃色固體,則A為Na、B為Na2O、C為Na2O2,C長期露置于空氣中,經過系列變化,最后將變成物質D,D為Na2CO3,過氧化鈉能與CO2反應生成碳酸鈉與氧氣,反應的化學方程式是2Na2O2+2 CO2=2 Na2CO3+O2↑,
2SO3;(2)若A是一種活潑金屬,C是淡黃色固體,則A為Na、B為Na2O、C為Na2O2,C長期露置于空氣中,經過系列變化,最后將變成物質D,D為Na2CO3,過氧化鈉能與CO2反應生成碳酸鈉與氧氣,反應的化學方程式是2Na2O2+2 CO2=2 Na2CO3+O2↑,
令混合物中碳酸氫鈉的質量為m,則:
2NaHCO3 | 質量減少 |
168 | 62 |
m | 10g﹣9.38g=0.62g |
故m= ![]() =1.68g,故碳酸鈉的質量分數=
=1.68g,故碳酸鈉的質量分數= ![]() ×100%=83.2%,
×100%=83.2%,
所以答案是:2Na2O2+2 CO2=2 Na2CO3+O2↑;Na2CO3;83.2%;(3)若C是紅棕色氣體,A可能是一種能使濕潤的紅色石蕊試紙變藍的氣體,則A為NH3,B為NO,C為NO2,
①氨氣在催化作用下可與氧氣反應生成NO,方程式為4NH3+5O2 ![]() NO+6H2O,所以答案是:4NH3+5O2
NO+6H2O,所以答案是:4NH3+5O2 ![]() NO+6H2O;
NO+6H2O;
②A為氨氣,極易溶于水,密度比空氣小,可用向下排空氣法收集,檢驗氨氣是否收集滿,可將濕潤的紅色石蕊試紙置于試管口處,若試紙變藍,則證明氨氣已收集滿,或用白色的酚酞試紙置于試管口處,若試紙變紅,則證明氨氣已收集滿,也可以用蘸有濃鹽酸的玻璃棒靠近試管口處,若產生大量白煙,則證明氨氣已收集滿,
所以答案是:將濕潤的紅色石蕊試紙置于試管口處,若試紙變藍,則證明氨氣已收集滿(或用蘸有濃鹽酸的玻璃棒靠近試管口處,若產生大量白煙,則證明氨氣已收集滿);
③工業上用氮氣和氫氣在高溫高壓下,催化作用下制備氨氣,方程式為N2+3H2 ![]() 2NH3,所以答案是:N2+3H2
2NH3,所以答案是:N2+3H2 ![]() 2NH3;
2NH3;
④二氧化氮和氧氣反應生成硝酸,方程式為4NO2+O2+2H2O=4HNO3,由方程式可知1mol二氧化氮與0.25mol氧氣反應,所以答案是:0.25 mol.


 陽光試卷單元測試卷系列答案
陽光試卷單元測試卷系列答案科目:高中化學 來源: 題型:
【題目】下列有關化學鍵的敘述,正確的是
A. 離子化合物中一定含有離子鍵
B. 單質的分子中均不存在化學鍵
C. 含有共價鍵的化合物一定是共價化合物
D. 化學鍵可以存在于原子之間也可以存在于分子之間
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組設計出如圖所示裝置來進行“銅與硝酸反應”實驗,以探究化學實驗的綠色化. 
(1)實驗前,關閉活塞b,試管d中加水至浸沒長導管口,塞緊試管c和d的膠塞,加熱c,其目的是 .
(2)在d中加適量NaOH溶液,c中放一小塊銅片,由分液漏斗a向c中加入2mL濃硝酸,c中反應的化學方程式是 . 再由a向c中加2mL蒸餾水,c中的實驗現象是 .
(3)如表是制取硝酸銅的三種方案,能體現綠色化學理念的最佳方案是 , 理由是、 .
方 案 | 反 應 物 |
甲 | Cu、濃HNO3 |
乙 | Cu、稀HNO3 |
丙 | Cu、O2、稀HNO3 |
(4)該小組還用上述裝置進行實驗證明氧化性KMnO4>Cl2>Br2 . 操作步驟為:實驗現象為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】丙烯腈(CH2=CHCN)是一種重要的化工原料,工業上可用“丙烯氨氧化法”生產.主要副產物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)等。回答下列問題:
(1)以丙烯、氨、氧氣為原料,在催化劑存在下生成丙烯腈(C3H3N)和副產物丙烯醛(C3H4O)。熱化學方程式如下:①C3H6(g)+NH3(g)+ ![]() O2(g)═C3H3N(g)+3H2O(g)△H=﹣515kJmol﹣1 ②C3H6(g)+O2(g)═C3H4O(g)+H2O(g)△H=﹣353kJmol﹣1
O2(g)═C3H3N(g)+3H2O(g)△H=﹣515kJmol﹣1 ②C3H6(g)+O2(g)═C3H4O(g)+H2O(g)△H=﹣353kJmol﹣1
兩個反應在熱力學上趨勢均很大,其原因是;有利于提高丙烯腈平衡產率的反應條件是;提高丙烯腈反應選擇性的關鍵因素是 .
(2)圖(a)為丙烯腈產率與反應溫度的關系曲線,最高產率對應的溫度為460℃.低于460℃時,丙烯腈的產率(填“是”或“不是”)對應溫度下的平衡轉化率,判斷理由是;高于460℃時,丙烯腈產率降低的可能原因是(雙選,填標號).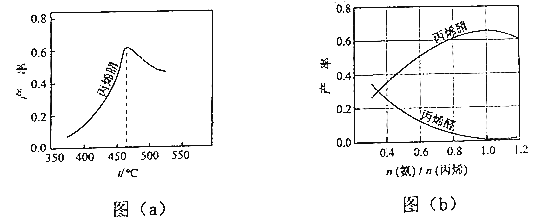
A.催化劑活性降低 B.平衡常數變大
C.副反應增多 D.反應活化能增大
(3)丙烯腈和丙烯醛的產率與n(氨)/n(丙烯)的關系如圖(b)所示.由圖可知,最佳n(氨)/n(丙烯)約為 , 理由是 . 進料氣氨、空氣、丙烯的理論體積比約為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】參照反應Br+H2﹣→HBr+H的能量對反應歷程的示意圖,下列敘述中正確的是( ) 
A.正反應為吸熱反應
B.正反應為放熱反應
C.加入催化劑,該化學反應的反應熱增大
D.從圖中可看出,該反應的反應熱與反應途徑有關
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質的分離方法不正確的是
A. 用過濾的方法除去食鹽水中的泥沙 B. 用蒸餾的方法除去自來水中的氯離子
C. 用酒精萃取碘水中的碘 D. 用淘洗的方法從沙里淘金
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將濃鹽酸、濃硫酸和新制氯水分別滴在三張藍色石蕊試紙上,這三張試紙最后的顏色是
A. 紅、紅、紅B. 紅、黑、白C. 紅、黑、紅D. 白、黑、紅
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com