
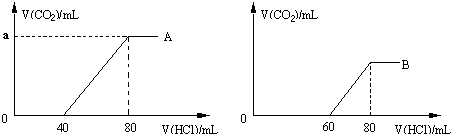
分析 (1)①A曲線中0-40mL沒有氣體生成,發生反應Na2CO3+HCl=NaHCO3+NaCl,40-80mL有氣體生成,發生NaHCO3+HCl=NaCl+H2O+CO2↑,根據反應方程式計算分析;
②B曲線中0-60mL沒有氣體生成,60-80mL有氣體生成,沒有氣體發生的反應消耗HCl多,所以當0<V(HCl)≤60時,發生碳酸鈉與鹽酸的反應還發生NaOH與鹽酸的反應;
(2)A曲線中0-40mL沒有氣體生成,發生反應Na2CO3+HCl=NaHCO3+NaCl,40-80mL有氣體生成,發生NaHCO3+HCl=NaCl+H2O+CO2↑,由Na原子守恒計算NaOH的物質的量和濃度;B溶液中繼續通二氧化碳,最后溶質全部轉化為碳酸氫鈉,結合發生的反應計算.
解答 解:(1)①A曲線中0-40mL沒有氣體生成,發生反應Na2CO3+HCl=NaHCO3+NaCl,40-80mL有氣體生成,發生NaHCO3+HCl=NaCl+H2O+CO2↑,兩段消耗的鹽酸的體積相同,由方程式的計量數可知,溶液中的溶質為Na2CO3,在40-80mL時,鹽酸的物質的量為0.1mol•L-1×0.04L=0.004mol,所以生成的二氧化碳為0.004mol,其體積為0.004mol×22.4L/mol=0.0896L=89.6mL;
故答案為:Na2CO3;89.6;
②B曲線中0-60mL沒有氣體生成,60-80mL有氣體生成,沒有氣體發生的反應消耗HCl多,所以當0<V(HCl)≤60時,發生碳酸鈉與鹽酸的反應還發生NaOH與鹽酸的反應,則當0<V(HCl)≤60時,發生的反應的方程式為:NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaHCO3+NaCl;
故答案為:NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaHCO3+NaCl;
(2)A曲線中0-40mL沒有氣體生成,發生反應Na2CO3+HCl=NaHCO3+NaCl,40-80mL有氣體生成,發生NaHCO3+HCl=NaCl+H2O+CO2↑,兩個反應消耗的鹽酸相同,則兩個反應一共消耗的鹽酸為n(HCl)=0.004mol×2=0.008mol,則n(NaCl)=0.008mol,由Na原子守恒可知n(NaOH)=0.008mol,所以c(NaOH)=$\frac{0.008mol}{0.05L}$=0.16mol/L;
0.008molNaOH全部轉化為NaHCO3需要二氧化碳為0.008mol,B曲線中60-80mL,生成的二氧化碳為0.1mol•L-1×0.02L=0.002mol,所以若溶質全部轉化為碳酸氫鈉
還需要通入二氧化碳為0.008mol-0.002mol=0.006mol,其體積為0.006mol×22.4L/mol=0.1344L=134.4mL;,
故答案為:0.16;134.4mL.
點評 本題考查混合物的有關計算,側重分析與計算能力、圖象與反應對應關系判斷能力的考查,把握圖中曲線及發生的反應的關系結合消耗鹽酸體積判斷CO2與NaOH反應產物是關鍵,題目難度較大.


 各地期末復習特訓卷系列答案
各地期末復習特訓卷系列答案 小博士期末闖關100分系列答案
小博士期末闖關100分系列答案 名校名師培優作業本加核心試卷系列答案
名校名師培優作業本加核心試卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 用浸泡過高錳酸鉀溶液的硅土吸收水果釋放的乙烯,可達到水果保鮮的目的 | |
| B. | 在結冰的路面上撒鹽,是利用鹽與水發生化學反應放出大量熱量,促使冰雪融化 | |
| C. | 食鹽是咸味劑,工業上常用電解飽和食鹽水制備氯氣和鈉 | |
| D. | 太陽能電池板中的硅是二氧化硅,光導纖維的主要成分是硅單質 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗組 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H+ | B. | K+ | C. | Cl- | D. | Ba2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 丙烷燃燒的熱化學方程式可表示為:C3H8(g)+5O2(g)=3CO2(g)+4H2O(g);△H=-2221.5 kJ•mol-1 | |
| B. | 正丁烷燃燒的熱化學方程式可表示為:2C4H10(g)+18O2(g)=8CO2(g)+10H2O(l);△H=-2878 kJ•mol-1 | |
| C. | 正丁烷轉化為異丁烷的過程是一個放熱過程 | |
| D. | 正丁烷比異丁烷穩定 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 滴定次數 | 滴定前讀數(mL) | 滴定后讀數(mL) |
| 1 | 1.20 | 16.21 |
| 2 | 3.00 | 18.90 |
| 3 | 4.50 | 19.49 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com