
| A. | 向水中加入少量Na固體,平衡逆向移,c(H+)降低 | |
| B. | 向水中加入稀氨水,平衡逆向移動,c(OH-)降低 | |
| C. | 向水中加入少量硫酸氫鈉固體,c(H+)增大,Kw不變動 | |
| D. | 將水加熱,Kw增大,pH不變 |
分析 A.Na和水反應生成NaOH,NaOH電離出氫氧根離子導致c(OH-)升高,溫度不變離子積常數不變;
B.一水合氨電離出氫氧根離子導致c(OH-)升高;
C.硫酸氫鈉電離出氫離子導致c(H+)增大,溫度不變離子積常數不變;
D.升高溫度促進水電離導致c(H+)、c(OH-)增大.
解答 解:A.Na和水反應生成NaOH,NaOH電離出氫氧根離子導致c(OH-)升高,抑制水電離平衡逆向移動,c(H+)降低,但溫度不變離子積常數不變,故A錯誤;
B.一水合氨電離出氫氧根離子導致c(OH-)升高,抑制水電離平衡逆向移動,故B錯誤;
C.硫酸氫鈉電離出氫離子導致c(H+)增大,抑制水電離導致平衡逆向移動,但溫度不變離子積常數不變,故C正確;
D.升高溫度促進水電離導致c(H+)、c(OH-)增大,所以離子積常數增大,pH減小,故D錯誤;
故選C.
點評 本題以水的電離為載體考查弱電解質的電離,明確弱電解質電離及離子積常數影響因素是解本題關鍵,注意:離子積常數只與溫度有關,與溶液濃度及溶解度無關,注意硫酸氫鈉電離特點,題目難度不大.


 百年學典課時學練測系列答案
百年學典課時學練測系列答案科目:高中化學 來源: 題型:解答題
時間s 濃度mol/L | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
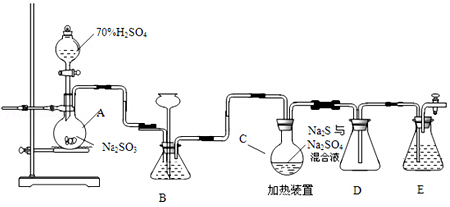
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 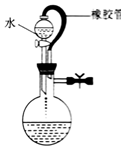 該裝置氣密性良好 | B. |  實驗室制備氯氣 | ||
| C. | 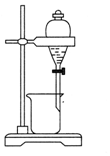 分離酒精和水 | D. |  蒸干NH4Cl溶液制NH4Cl固體 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 75mL 2mol•L-1氯化鎂溶液 | B. | 150mLl 1 mol•L-1氯化鈉溶液 | ||
| C. | 50mL3mol•L-1氯化鉀溶液 | D. | 50mL 1 mol•L-1氯化鐵溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 6.72 L CO | B. | 6.6 g CO2 | C. | 24 g SO3 | D. | 9.8 g H2SO4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com