
【題目】“西氣東輸”是西部開發的重點工程,這里的氣體是指天然氣,其主要成分是甲烷.工業上將碳與水在高溫下反應制得水煤氣,水煤氣的主要成分是CO和H2 , 兩者的體積比約為1:1.已知1mol CO氣體完全燃燒生成CO2氣體放出283kJ熱量,1molH2完全燃燒生成液態水放出286kJ熱量;1molCH4 氣體完全燃燒生成CO2氣體和液態水放出890kJ熱量.
(1)寫出H2完全燃燒生成液態水的熱化學反應方程式: , 若1molCH4氣體完全燃燒生成CO2氣體和水蒸氣,放出的熱量 890kJ(填“>”、“=”或“<”)
(2)忽略水煤氣中其它成分,相同狀況下若得到相等的熱量,所需水煤氣與甲烷的體積比約為;燃燒生成的CO2 的質量比約為 .
(3)以上數據和計算說明,以天然氣代替水煤氣作民用燃料,突出的優點是 .
【答案】
(1)2H2(g)+O2(g)=2H2O(l)△H=﹣572kJ?mol﹣1;<
(2)3.1:1;1.55:1
(3)熱值高,污染小
【解析】解:(1)1mol H2完全燃燒生成液態水放出286kJ熱量,所以H2完全燃燒生成氣態水的熱化學方程式:2H2(g)+O2(g)=2H2O(l)△H=﹣572kJmol﹣1;1mol CH4氣體完全燃燒生成CO2氣體和液態水放出890kJ熱量,液態水變為氣態水吸熱,所以相同條件下,1mol CH4氣體完全燃燒生成CO2氣體和水蒸氣,放出的熱量小于890kJ;
所以答案是:2H2(g)+O2(g)=2H2O(l)△H=﹣572kJmol﹣1;<;(2)依據熱化學方程式:2H2(g)+O2(g)=2H2O(l)△H=﹣572kJmol﹣1;CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890kJ/mol;2CO(g)+O2(g)=2CO2(g)△H=﹣566KJ/mol;水煤氣中主要成分是CO和H2 , 二者的體積比為1:1,1molCH4燃燒放熱890kJ,1molCO、H2混合氣體放熱 ![]() kJ=284.5kJ,相同狀況下若得到相等的熱量,所需水煤氣與甲烷的體積比約為
kJ=284.5kJ,相同狀況下若得到相等的熱量,所需水煤氣與甲烷的體積比約為 ![]() :
: ![]() =3.1:1,燃燒生成的CO2的質量比約為
=3.1:1,燃燒生成的CO2的質量比約為 ![]() =1.55:1;
=1.55:1;
所以答案是:3.1:1;1.55:1;(3)以上數據和計算說明,相同物質的量的天然氣和水煤氣,天然氣燃燒放出的熱量多,即熱值高,燃燒產生的溫室氣體CO2少,所以答案是:熱值高,污染小.


 直通貴州名校周測月考直通名校系列答案
直通貴州名校周測月考直通名校系列答案 培優三好生系列答案
培優三好生系列答案科目:高中化學 來源: 題型:
【題目】研究性學習小組的同學想通過下圖實驗裝置探究SO2與Na2O2反應的產物。(夾持裝置已略去,裝置的氣密性良好)
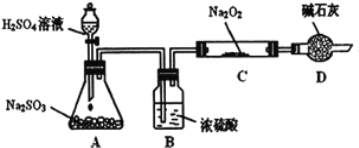
Ⅰ.實驗中裝置B可吸收水分,干燥SO2氣體,其目的是:________________。裝置D除了吸收過量的SO2,避免污染空氣外,還起到的作用是:_______。
Ⅱ.對C中固體產物提出如下假設:(假設Na2O2已全部反應)
假設1:__________。
假設2:只有Na2SO4; 假設3:既有Na2SO3又有Na2SO4。
(1)甲同學認為SO2與Na2O2的反應不同于CO2,應為假設2成立,請據此寫出C中所發生反應的化學方程式:_____________________。
(2)若假設2成立,為確定C中固體產物的成分,甲同學設計如下實驗:
![]()
得出結論:C中固體產物只有Na2SO4。該方案是否合理?答:__________。(填“是”或“否”)理由是______________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z三種氣體,取X和Y按1:1的物質的量之比混合,放入密閉容器中發生如下反應:X+2Y2Z,達到平衡后,測得混合氣體中反應物的總物質的量與生成物的總物質的量之比為3:2,則Y的轉化率最接近于( )
A.33%
B.40%
C.50%
D.65%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列實驗操作和現象所得到的結論正確的是
選項 | 實驗操作和現象 | 結論 |
A | 測定等物質的量濃度的Na2CO3和Na2SO4溶液的pH,前者的PH比后者的大 | 元素非金屬性:S>C |
B | 向盛有Fe(NO3)2溶液的試管中加入0.lmol.L-1H2SO4溶液,試管口出現紅棕色氣體 | 溶液中NO3-被Fe2+還原為NO2 |
C | 向FeBr2溶液中加入少量氯水,再加CCl4萃取,CCl4層無色 | Fe2+的還原性強于Br- |
D | 向溶液中滴加鹽酸酸化的BaC12溶液,產生白色沉淀 | 溶液中一定含有SO42- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)1mol NH4+質量為_____,其中含質子、電子的數目分別為_____、_____。
(2)標準狀態下,672mL某氣體質量為0.84g,該氣體摩爾質量為_____。
CO 和CO2 混合氣體的密度相對氫氣為19,則CO 和CO2體積比為_________,若某原子的摩爾質量是M g /mol,則一個該原子的真實質量是____________g;將標準狀況下的aLHCl(g)溶于1000g水中,得到的鹽酸密度為bg/mL,則該鹽酸的物質的量濃度是___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳酸錳(MnCO3) 是理想的高性能強磁性材料,也是制備Mn2O3、MnO2等錳的氧化物的重要原料,廣泛用于電子、化工、醫藥等行業。
(1) 工業上制備方程式為:MnSO4+2NH4HCO3=MnCO3 ↓+ (NH4)2SO4+CO2 ↑+H2O。反應中通常需加入稍過量的NH4HCO3,且控制溶液的pH為6.8~7.4。加入稍過量的NH4HCO3的目的是_____。
(2) 實驗室模擬工業二氧化錳制備硫酸錳裝置如圖4所示。

①石灰乳的作用是________。
②反應過程中,為使SO2盡可能轉化完全,在通入SO2和N2比例一定、不改變固液投料的條件下,可采取的合理措施有________。
(3) MnCO3 在空氣中加熱易轉化為不同價態的錳的氧化物,且其固體殘留率隨溫度的變化如圖5 中A、B、C、D 點所示。則300℃時,剩余固體中錳元素與氧元素的物質的量之比即n(Mn) :n(O)為_______; 圖中點D 對應固體的成分為______ (填化學式)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室常用濃鹽酸與二氧化錳反應來制取少量的氯氣,反應的化學方程式為MnO2+4HCl(濃)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)寫出該反應的離子方程式__________________________________________
(2)在反應中MnO2發生________(填“氧化”或“還原”)反應。氧化產物為__________
(3)當0.1 mol MnO2參加反應時,轉移電子數為____,被氧化的HCl為________mol。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com