
分析 (1)由題給信息可知Fe2+轉化為Fe3+而中毒,服用維生素C可以解毒,說明在維生素C作用下Fe3+又轉化為Fe2+;
(2)A.亞硝酸鈉是強堿弱酸鹽其水溶液呈堿性,氯化鈉是強酸強堿鹽其水溶液呈中性;
B.甲基橙的變色范圍是3.1-4.4;
C.酸性條件下,亞硝酸根離子能被碘離子還原生成一氧化氮,同時生成碘單質;
D.亞硝酸根離子不和銀離子反應,氯離子和銀離子反應生成白色沉淀;
(3)把新制的氯水加到NaNO2溶液中,觀察到氯水褪色,同時生成NaNO3和HCl,二者發生氧化還原反應;
(4)Cl2、HNO3都能氧化亞鐵離子,但能引入新的雜質,鐵不能氧化亞鐵離子,雙氧水的還原產物是水,不引入雜質;
(5)根據方程式可知,鐵元素的化合價從+2價升高到+6價,失去4個電子;氧元素的化合價從-1價升高到0價,失去1個電子,氧元素的化合價從-1價降低到-2價,得到1個電子,然后根據電子的得失守恒和質量守恒定律配平方程式.
解答 解:(1)服用維生素C可以解毒,說明在維生素C作用下Fe3+又轉化為Fe2+,Fe元素化合價降低,被氧化,則維生素具有還原性,而亞硝酸鹽,會導致Fe2+轉化為Fe3+,說明亞硝酸鹽具有氧化性被還原,在反應中為氧化劑,所以維生素C是還原劑,
故答案為:D;
(2)A.亞硝酸鈉是強堿弱酸鹽其水溶液呈堿性,氯化鈉是強酸強堿鹽其水溶液呈中性,相同物質的量濃度的兩種溶液的pH不同,所以可以用測定這兩種溶液的pH值鑒別,故A不選;
B.亞硝酸鈉是強堿弱酸鹽其水溶液呈堿性,氯化鈉是強酸強堿鹽其水溶液呈中性,甲基橙的變色范圍是3.1-4.4,所以亞硝酸鈉和氯化鈉溶液加入甲基橙后溶液都呈黃色,反應現象相同,所以不能用甲基橙鑒別,故B選;
C.在酸性條件下,亞硝酸鈉和碘離子反應方程式為2NO2-+2I-+4H+=2NO↑+I2+2H2O,碘遇淀粉變藍色,氯離子和碘離子不反應,所以反應現象不同,所以可以用酸性條件下的KI淀粉試液來區別,故C不選;
D.亞硝酸根離子不和銀離子反應,氯離子和銀離子反應生成不溶于硝酸的白色沉淀,反應現象不同,所以可以用AgNO3和HNO3兩種試劑來區別,故D不選;
故答案為:B;
(3)觀察到氯水褪色,同時生成NaNO3和HCl,反應的離子方程式為:NO2-+Cl2+H2O=NO3-+2H++2Cl-,
故答案為:NO2-+Cl2+H2O=NO3-+2H++2Cl-;
(4)ad都能氧化亞鐵離子,但能引入新的雜質,鐵不能氧化亞鐵離子,雙氧水的還原產物是水,不引入雜質,所以正確額的答案選c;
故選:c;
(5)根據方程式可知,鐵元素的化合價從+2價升高到+6價,失去4個電子;氧元素的化合價從-1價升高到0價,失去1個電子,氧元素的化合價從-1價降低到-2價,得到1個電子,最小公倍數是8,所以硫酸亞鐵前面配2,K2O2前面配6,再根據質量守恒配平其他物質,配平后的方程式為:2FeSO4+6K2O2═2K2FeO4+2K2SO4+2K2O+O2;由反應方程式可知轉移10NA個電子,生成22.4L的氧氣,轉移了1.5NA個電子時,在標況下可收集到$\frac{1.5}{10}$×22.4L=3.36L;
故答案為:2、6、2、2、2、1;3.36.
點評 本題考查了二價鐵離子與三價鐵離子的轉化、氧化還原方程式書寫,側重于學生的分析能力的考查,明確氧化還原反應規律是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:解答題
 苯乙烯(
苯乙烯(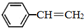 )是生產各種塑料的重要單體,可通過乙苯催化脫氫制得:
)是生產各種塑料的重要單體,可通過乙苯催化脫氫制得: CH2CH3(g)$\stackrel{催化劑}{?}$
CH2CH3(g)$\stackrel{催化劑}{?}$ =CH2(g)+H2(g)△=-Q1kJ.mol-1
=CH2(g)+H2(g)△=-Q1kJ.mol-1 .
.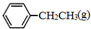 、
、 、H2(g)的燃燒熱(△H)分別為-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,寫出Q與Q1、Q2、Q3的關系式Q2+Q3-Q1.
、H2(g)的燃燒熱(△H)分別為-Q1 kJ•mol-1、-Q2kJ•mol-1、-Q3 kJ•mol-1,寫出Q與Q1、Q2、Q3的關系式Q2+Q3-Q1.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 常溫下,向25mL 0.1mol•L-1 MOH 溶液中逐滴加入0.2mol•L-1 HA溶液,曲線如圖所示(體積變化忽略不計).回答下列問題:
常溫下,向25mL 0.1mol•L-1 MOH 溶液中逐滴加入0.2mol•L-1 HA溶液,曲線如圖所示(體積變化忽略不計).回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,5.6 L四氯化碳含有的分子數為0.25NA | |
| B. | 標準狀況下,14 g氮氣與11.2LNH3含有的原子數相同 | |
| C. | 標準狀況下,22.4 L任意比的氫氣和氯氣的混合氣體中含有的分子總數均為NA | |
| D. | 物質的量濃度為0.5mol/L MgCl2溶液,含有Cl-離子數為1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 兩種不溶物的Ksp相差越大,不溶物就越容易轉化為更難溶的不溶物 | |
| B. | 常溫下,濃度均為0.1mol/L①醋酸、②鹽酸、③醋酸鈉溶液,水電離程度的順序為③>①>② | |
| C. | 常溫下,將相同體積的pH=3硫酸和pH=11一元堿BOH溶液混合,所得溶液可能為中性也可能為酸性 | |
| D. | 物質的濃度相同的①氯化銨溶液、②硫酸銨溶液、③碳酸氫銨溶液,pH的順序為:③>①>② |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
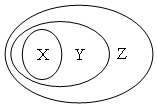 用下圖表示的一些物質或概念間的從屬關系中不正確的是( )
用下圖表示的一些物質或概念間的從屬關系中不正確的是( )| X | Y | Z | |
| A | 氧化物 | 化合物 | 純凈物 |
| B | 氯化鈉 | 電解質 | 化合物 |
| C | 金屬氧化物 | 堿性氧化物 | 氧化物 |
| D | 牛奶 | 膠體 | 分散系 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 微量元素缺少或者攝入過多,都可能導致患各種代謝疾病 | |
| B. | 兒童缺鋅可導致生長發育不良,抵抗力差,食欲不振 | |
| C. | 人體缺鈣,可以多喝硬水補鈣 | |
| D. | 缺鐵性貧血,可通過食用鐵強化醬油預防 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在水中加入少量ZnSO4固體時,水的電離平衡向正反應方向移動,Kw減小 | |
| B. | 在ZnSO4溶液中各離子的濃度關系為:2c(Zn2+)+c(H+)═c(OH-)+2c(SO42-) | |
| C. | 在0.5 L 0.10 mol•L-1的ZnSO4溶液中加入等體積的0.02 mol•L-1的AgNO3溶液,即可生成Ag2SO4沉淀 | |
| D. | 常溫下,要除去0.20 mol•L-1 ZnSO4溶液中的Zn2+,至少要調節pH≥8 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com