
| 滴定次數 實驗數據 | 1 | 2 | 3 | 4 |
| V(樣品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初讀數) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(終讀數) | 14.98 | 15.20 | 15.12 | 15.95 |
| V(NaOH)/mL(消耗) | 14.98 | 15.00 | 15.02 | 15.95 |
| V(NaOH)/mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 |
| 溶液pH | 2.88 | 4.70 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 |
| 指示劑 | 變色的范圍(pH) |
| 甲基橙 | 3.1~4.4 |
| 石蕊 | 5.0~8.0 |
| 酚酞 | 8.2~10.0 |
 =15.00ml;c(樣品)V(樣品)=c(NaOH)V(NaOH)
=15.00ml;c(樣品)V(樣品)=c(NaOH)V(NaOH) =4.5g/100ml;
=4.5g/100ml;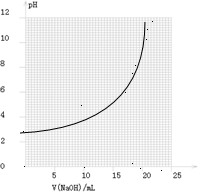 ;故答案為:
;故答案為: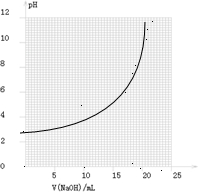


科目:高中化學 來源: 題型:閱讀理解
| 滴定次數 實驗數據 |
1 | 2 | 3 | 4 |
| V(樣品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初讀數) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(終讀數) | 14.98 | 15.20 | 15.12 | 15.95 |
| V(NaOH)/mL(消耗) | 14.98 | 15.00 | 15.02 | 15.95 |
| V(NaOH)/mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 |
| 溶液pH | 2.88 | 4.70 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 |
| 指示劑 | 變色的范圍(pH) |
| 甲基橙 | 3.1~4.4 |
| 石蕊 | 5.0~8.0 |
| 酚酞 | 8.2~10.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 滴定次數 實驗數據 |
1 | 2 | 3 | 4 |
| V(樣品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初讀數) | 0.00 | 0.200 | 0.10 | 0.00 |
| V(NaOH)/mL(終讀數) | 14.98 | 15.20 | 15.12 | 15.95 |
| V(NaOH)/mL(消耗) | 14.98 | 15.00 | 15.02 | 15.95 |
查看答案和解析>>
科目:高中化學 來源:連州中學2008屆高三化學第二輪復習實驗題訓練 題型:058
某實驗小組擬用酸堿中和滴定法測定食醋的總酸量(g/100 mL),現邀請你參與本實驗并回答相關問題.(有關實驗藥品為:市售食用白醋樣品500 mL、0.1000 mol/LNaOH標準溶液、蒸餾水、0.1%甲基橙溶液、0.1%酚酞溶液、0.1%石蕊溶液.)
Ⅰ.實驗步驟:
(1)用滴定管吸取10 mL市售白醋樣品,置于100 mL容量瓶中,加蒸餾水(煮沸除去CO2并迅速冷卻))稀釋至刻度線,搖勻即得待測食醋溶液.
(2)用酸式滴定管取待測食醋溶液20.00 mL于________中.
(3)盛裝標準NaOH溶液,靜置后,讀取數據,記錄為NaOH標準溶液體積的初讀數.
(4)滴定,并記錄NaOH的終讀數.重復滴定2-3次.
Ⅱ.實驗記錄及數據處理
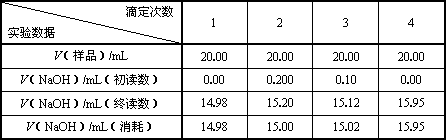
則c(樣品)/moL·L-1=________;樣品總酸量g / 100mL=________.
Ⅲ.交流與討論:
(1)甲同學在處理數據過程中計算得:
V(NaOH)(平均消耗)=1/4(14.98+15.00+15.02+15.95)mL=15.24 mL.
試分析他的計算是否合理,如果不合理請說明理由.
________________________________________________________________.
(2)乙同學用0.1000 mol/L NaOH溶液滴定另一市售白醋樣品溶液時,滴定過程中使用pH計將溶液的pH變化情況記錄如下表.
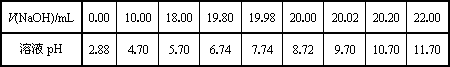
①請作出pH-V(NaOH)圖.
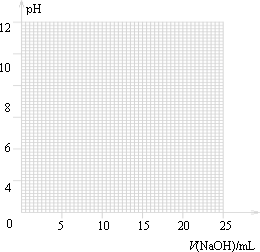
①由表和圖可知:在允許的誤差范圍(±0.1%)內,pH突變
(滴定突躍)范圍為________.
所以可選擇________作指示劑.
附:常見指示劑的變色范圍

查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
過氧化氫是重要的氧化劑和還原劑,常用于消毒、殺菌、漂白等。請回答相關問題:
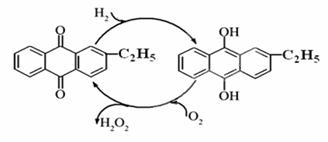
(1)目前常用乙基蒽醌法制備過氧化氫,主要過程如下圖,此過程的總方程式為 。
(2)實驗測得常溫下質量分數為0.51%H2O2水溶液(密度為1g/mL)的pH為5
i.寫出H2O2溶于水的電離方程式 .
ii.測定H2O2水溶液pH的方法為(填編號)
A.用酸堿指示劑測定 B.用廣泛pH試紙測定
C.用精密pH試紙測定 D.用pH計測定
(3)某實驗小組擬研究濃度、催化劑、溶液酸堿性對H2O2分解反應速率的影響。在常溫下按照如下方案完成實驗。
| 實驗編號 | 反應物 | 催化劑 |
| ① | 10 mL 2% H2O2溶液 | 無 |
| ② | 10 mL 5% H2O2溶液 | 無 |
| ③ | 10 mL 5% H2O2溶液 | 0.1gMnO2粉末 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 0.1gMnO2粉末 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 0.1gMnO2粉末 |
i.實驗①和②的目的是_______。實驗時由于沒有觀察到明顯現象而無法得出結論。資料顯示,通常條件下H2O2較穩定,不易分解。為了達到實驗目的,你對原實驗方案的改進是_________。
ii.實驗③、④、⑤中,測得生成氧氣的體積隨時間變化的關系如圖所示。
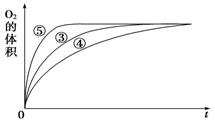
分析該圖能夠得出的實驗結論是____________。
(4)實驗室常用酸性高錳酸鉀標準溶液測定雙氧水的濃度,反應原理為:
MnO4-+H2O2+H+ —Mn2++H2O+ O2↑
i.請配平以上離子方程式
ii.用移液管吸取25.00mL試樣置于錐形瓶中,重復滴定四次,每次消耗0.1000 mol·L-1的KMnO4標準溶液體積如下表所示:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| 體積(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
計算試樣中過氧化氫的濃度為 mol·L-1。
iii.若滴定前尖嘴中有氣泡滴定后消失,則測定結果 (“偏高”或“偏低”或“不變”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com