
【題目】某學習小組用如圖裝置(支撐儀器略去)探究乙醇的催化氧化反應。
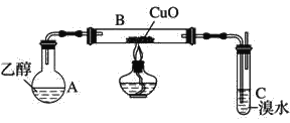
(1)實驗開始時,對A進行水浴加熱,其目的是__。
(2)B中反應方程式為__。
(3)若裝置C中開始發生倒吸,則采取的應急措施是__(填編號)。
a.移去圖中的酒精燈 b.將C中橡皮塞拔出
c.將B尾端的乳膠管取下 d.將A與B之間的乳膠管取下
(4)探究:充分反應后,觀察到溴水完全褪色。學習小組通過測定反應前溴水中n(Br2)與反應后溶液中n(Br﹣)來確定乙醛使溴水褪色的原因。
①假設:請寫出假設1的反應類型。
假設1:CH3CHO+Br2→CH2BrCHO+HBr__;
假設2:CH3CHO+Br2→CH3CHBrOBr 加成反應;
假設3:CH3CHO+Br2+H2O→CH3COOH+2HBr 氧化反應。
①結論:若實驗測得n(Br2)=0.005mol,n(Br﹣)=0.01mol,則證明假設__正確。
【答案】產生平穩的乙醇氣流 CH3CH2OH+CuO![]() CH3CHO+Cu+H2O c 取代反應 3
CH3CHO+Cu+H2O c 取代反應 3
【解析】
(1)加熱時采用水浴加熱可以讓乙醇平穩氣化成乙醇蒸氣;
(2)乙醇與氧化銅反應生成乙醛、Cu與水;
(3)乙醛與溴水反應,導致裝置內壓強降低,發生倒吸,采取應急措施,避免C中溶液倒吸到B中而發生炸裂;
(4)①根據反應物與生成物的結構,可知乙醛甲基中的H原子被Br原子取代;
②實驗測得n(Br2)=0.005mol,n(Br-)=0.01mol,則n(Br2):n(Br-)=1:2,可以確定反應是按假設3進行的;
(1)為使A中乙醇平穩氣化成乙醇蒸氣,常采用的方法是水浴加熱;
故答案為:產生平穩的乙醇氣流;
(2)乙醇與氧化銅反應得到乙醛、Cu與水,反應方程式為CH3CH2OH+CuO![]() CH3CHO+Cu+H2O;
CH3CHO+Cu+H2O;
故答案為:CH3CH2OH+CuO![]() CH3CHO+Cu+H2O;
CH3CHO+Cu+H2O;
(3)a.移去圖中的酒精燈,導致B中的壓強更小,倒吸更嚴重,故a不可行;
b.將C中的橡皮塞拔出,并沒有減小大氣壓,并且乙醛有毒污染空氣,仍然倒吸,故b不可行;
c.將B尾端的乳膠管取下,使B與C斷開連接,避免C中溶液倒吸到B中而發生炸裂,故c可行;
d.將A與B之間的乳膠管取下,使B與大氣相通,氣壓與C相同,但C中已經倒吸的溶液可能進入B中發生炸裂,故d不可行;
故答案選:c;
(4)①根據反應物與生成物的結構,可知乙醛甲基中的H原子被Br原子取代,反應取代反應;
故答案為:取代;
②實驗測得n(Br2)=0.005mol,n(Br﹣)=0.01mol,則n(Br2):n(Br﹣)=1:2,乙醛與溴水的反應按假設3進行;
故答案為:3;


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】常溫下,將除去表面氧化膜的Al、Cu片插入濃HNO3中組成原電池(如圖1),測得原電池的電流強度(I)隨時間(t)的變化如圖2所示,已知0-t1時,原電池的負極是Al片,反應過程中有紅棕色氣體產生。下列說法不正確的是

A. 0-t1時,正極的電極反應式為:2H++ NO3- - e-=NO2+ H2O
B. 0-t1時,溶液中的H+ 向Cu電極移動
C. t1時,負極的電極反應式為:Cu–2e-= Cu2+
D. t1時,原電池中電子流動方向發生改變是因為Al在濃硝酸中鈍化,氧化膜阻礙了Al的進一步反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下圖所示的實驗裝置制取乙酸乙酯。回答以下問題:
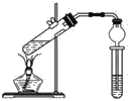
(1)在大試管中配制一定比例的乙醇、乙酸和濃硫酸的混合液的方法是先向試管中加入一定量的________,然后邊振蕩邊緩緩加入________,冷卻后再加入一定量的________,輕輕振蕩使之混合均勻。
(2)濃硫酸的作用是__________________________
(3)飽和碳酸鈉溶液的作用是__________________________
(4)生成的乙酸乙酯,其密度比水________(填“大”或“小”),有________味。
(5)與書中采用的實驗裝置的不同之處是本實驗采用了球形干燥管代替了長導管,并將干燥管的末端插入了飽和碳酸鈉溶液中。在此處球形干燥管的作用有________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室從含碘廢液(含有I2、I-等)中回收碘,其實驗過程如下:
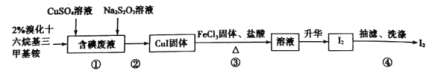
己知:溴化十六烷基三甲基銨是一種陽離子表面活性劑,可以中和沉淀表面所帶的負電荷,使沉淀顆粒快速聚集,快速下沉。下列說法錯誤的是
A.含碘廢液中是否含有IO3-,可用KI-淀粉試紙檢驗
B.步驟①中Na2S2O3可用Na2SO3代替
C.步驟②可以用傾析法除去上層清液
D.步驟③發生反應的離子方程式為:4Fe3++2CuI![]() 4Fe2++2Cu2++I2
4Fe2++2Cu2++I2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】檸檬酸(用H3R表示)是一種高效除垢劑。常溫時,用一定濃度的檸檬酸溶液去除水垢,溶液中H3R、H2R-、HR2-、R3-的物質的量百分數隨pH的變化如圖所示。下列說法正確的是
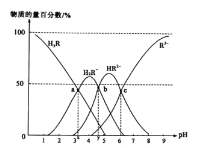
A.由a點判斷H3R的第一步電離常數Ka1(H3R)的數量級為10-3
B.若b點溶液中金屬陽離子只有Na+,則有c(Na+)=c(R3-)+c(HR2-)+c(H2R-)+c(H3R)
C.pH=6時,c(R3-)=c(HR2-)>c(H+)>c(OH-)
D.反應2H2R-![]() H3R+HR2-在該溫度下的平衡常數K=10x-y
H3R+HR2-在該溫度下的平衡常數K=10x-y
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】亞硝酰硫酸(NOSO4H)純品為棱形結晶,溶于硫酸,遇水易分解,常用于制染料。制備NOSO4H的反應原理為:![]() 、
、![]() 。
。
(1)亞硝酰硫酸(NOSO4H)的制備。
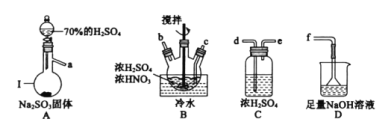
①儀器Ⅰ的名稱為_________。
②按氣流從左到右的順序,上述儀器的連接順序為____(填儀器接口字母,部分儀器可重復使用)。
③為了控制B中通入SO2的速率,可以采取的措施是_____。
④NOSO4H遇水分解的化學方程式為______,若去掉裝置C會使NOSO4H的產量____(填“增大”、“減少”或“無影響”)。
(2)亞硝酰硫酸(NOSO4H)純度的測定。
準確稱取1.337g產品加入250mL碘量瓶中,加入60.00mL濃度為0.1000mol·L-1KMnO4標準溶液和10mL25%H2SO4溶液,然后搖勻。用0.2500mol·L-1Na2C2O4標準溶液滴定,消耗Na2C2O4溶液的體積20.00mL。
己知:ⅰ. ![]() + NOSO4H+
+ NOSO4H+ ![]() 、 +
、 + ![]() +
+ ![]() +
+ ![]()
ⅱ.![]()
①完成反應ⅰ的離子方程式:
____![]() +____
+____![]() ____
____![]() ____+____
____+____![]() +____
+____![]() +____
+____![]()
②滴定終點的現象為________。
③產品的純度為_____%(保留兩位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三氧化二砷(As2O3)可用于治療急性早幼粒白血病。利用某酸性含砷廢水(含![]() 、H+、
、H+、![]() )可提取三氧化二砷,提取工藝流程如下:
)可提取三氧化二砷,提取工藝流程如下:
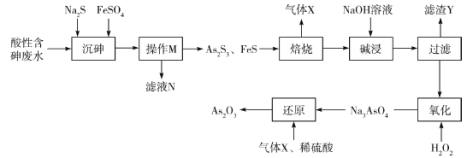
已知:①常溫下,![]() ;
;![]() 。
。
②As2O3+6NaOH=2Na3AsO3+3H2O。
③As2S3易溶于過量的Na2S溶液中,故加入FeSO4的目的是除去過量的S2-。
回答下列問題:
(1)操作M的名稱是________,濾液N中含有的陽離子有Fe2+、H+、________。
(2)“焙燒”操作中,As2S3參與反應的化學方程式為____________。
(3)“堿浸”的目的是_____________,“濾渣Y”的主要成分是_____________(寫化學式)。
(4)“氧化”中發生反應的離子方程式為___________________。
(5)該流程中可循環使用的物質是_________(寫化學式),某次“還原”過程中制得了1.98kgAs2O3,則消耗標準狀況下該物質的體積是________L。
(6)溶液中金屬離子的除去方法之一是Na2S沉降法。常溫下,若某溶液中含Fe2+、Ag+,且濃度均為0.1mol·L-1,則向該溶液中滴加稀Na2S溶液時,先生成的沉淀是________(填化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】正常人心臟在一次搏動中泵出血液約80 mL,正常人血壓(可看作心臟壓送血液的壓強)平均值為1.6×104Pa,心跳每分鐘約70次。設人類消耗體內的葡萄糖產生的熱量最高可有80%(睡眠時)用來維持心臟的跳動,葡萄糖與氧氣反應產生熱量的化學方程式為:C6H12O6(s)+6O2(g)―→6CO2(g)+6H2O(g)(放出熱量2804 kJ)
(1)心臟工作的平均功率約為______________;
(2)由于心臟跳動每天需消耗葡萄糖的質量是____________________________;
(3)維持生命每天需消耗氧氣的體積是___________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列解釋事實的方程式不正確的是
A. 用Na2S處理含Hg2+廢水:Hg2+ + S2 = HgS↓
B. 燃煤中添加生石灰減少SO2的排放:2CaO + O2 + 2SO2 ![]() 2CaSO4
2CaSO4
C. 工業上將Cl2 通入石灰乳中制漂白粉:Cl2 + OH- = Cl-+ ClO- + H2O
D. 向漂白液中加入適量潔廁靈(含鹽酸),產生氯氣:ClO-+ Cl-+2H+ = Cl2↑+ H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com