
4.6g銅鎂合金完全溶解于100ml密度為1.40g/ml、質量分數為63%的濃硝酸中,得到4480mlNO2和336 ml N2O4 的混合氣體(標準狀況),向反應后的溶液中加入1.0mol/LNaOH溶液至離子恰好全部沉淀時,下列說法不正確的是 (??? )
A.該合金中銅與鎂的物質的量之比是46:69
B.該濃硝酸中HNO3的物質的量濃度是14.0mol/L
C.產生沉淀8.51 g
D.離子恰好完全沉淀時,加入NaOH溶液的體積是230mL
D
【解析】
試題分析: A.4480mL NO2的物質的量= =0.2mol,336mL N2O4的物質的量=
=0.2mol,336mL N2O4的物質的量=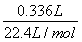 =0.015mol,令Cu、Mg的物質的量分別為xmol、ymol,根據二者質量與電子轉移守恒,可得:64x+24y=4.6,2x+2y=0.2+0.015×2 ,解得x=0.046、y=0.069,故該合金中銅與鎂的物質的量之比=0.046mol:0.069mol=46:69,故A正確;B.密度為1.40g·mL-1、質量分數為63%的濃硝酸.其物質的量濃度=
=0.015mol,令Cu、Mg的物質的量分別為xmol、ymol,根據二者質量與電子轉移守恒,可得:64x+24y=4.6,2x+2y=0.2+0.015×2 ,解得x=0.046、y=0.069,故該合金中銅與鎂的物質的量之比=0.046mol:0.069mol=46:69,故A正確;B.密度為1.40g·mL-1、質量分數為63%的濃硝酸.其物質的量濃度=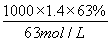 =14mol·L-1,故B正確;C.銅鎂合金完全溶解于濃硝酸中,向反應后的溶液中加入NaOH溶液至離子恰好全部沉淀,生成沉淀為Cu(OH)2、Mg(OH)2,由化學式可知n(OH-)=2n(Cu)+2n(Mg)=2×(0.046mol+0.069mol)=0.23mol,故沉淀質量=m(Cu)+m(Mg)+m(OH-)=4.6g+0.23mol×17g·mol-1=8.51g,故C正確;D.離子恰好完全沉淀時,此時溶液中溶質為NaNO3,根據N元素守恒可知n原(HNO3)=n(NaNO3)+n(NO2)+2n(N2O4),故n(NaNO3)=0.1L×14mol·L-1-0.2mol-2×0.015mol=1.17mol,根據鈉離子守恒有n(NaOH)=n(NaNO3)=1.17mol,故需要氫氧化鈉溶液的體積=
=14mol·L-1,故B正確;C.銅鎂合金完全溶解于濃硝酸中,向反應后的溶液中加入NaOH溶液至離子恰好全部沉淀,生成沉淀為Cu(OH)2、Mg(OH)2,由化學式可知n(OH-)=2n(Cu)+2n(Mg)=2×(0.046mol+0.069mol)=0.23mol,故沉淀質量=m(Cu)+m(Mg)+m(OH-)=4.6g+0.23mol×17g·mol-1=8.51g,故C正確;D.離子恰好完全沉淀時,此時溶液中溶質為NaNO3,根據N元素守恒可知n原(HNO3)=n(NaNO3)+n(NO2)+2n(N2O4),故n(NaNO3)=0.1L×14mol·L-1-0.2mol-2×0.015mol=1.17mol,根據鈉離子守恒有n(NaOH)=n(NaNO3)=1.17mol,故需要氫氧化鈉溶液的體積=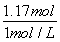 =1.17L=1170mL,故D錯誤,
=1.17L=1170mL,故D錯誤,
考點:考查混合物計算。


 小學課時作業全通練案系列答案
小學課時作業全通練案系列答案 金版課堂課時訓練系列答案
金版課堂課時訓練系列答案 單元全能練考卷系列答案
單元全能練考卷系列答案科目:高中化學 來源: 題型:
| A、該合金中銅與鎂的物質的量之比是46:69 | B、該濃硝酸中HNO3的物質的量濃度是14.0mol/L | C、產生沉淀8.51g | D、離子恰好完全沉淀時,加入NaOH溶液的體積是230mL |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、當生成的沉淀量達到最大時,消耗NaOH溶液的體積V≥100mL | B、當金屬全部溶解時收集到NO氣體的體積一定為2.24L | C、參加反應的金屬的總質量為9.6g>m>3.6g | D、當金屬全部溶解時,參加反應的硝酸的物質的量一定是0.4mol |
查看答案和解析>>
科目:高中化學 來源: 題型:
將一定質量的鎂、銅組成的混合物加入到稀硝酸中,金屬完全溶解(假設反應中還原產物全部是NO)。向反應后的溶液中加入3mol/LnaOH溶液至沉淀完全,測得生成沉淀的質量比原合金的質量增加5.1g,則下列敘述中正確的是 ( )
A.當生成沉淀達到最大量時,消耗NaOH溶液的體積為100mL
B.當金屬全部溶解時收集到NO氣體的體積為2.24L
C.參加反應的金屬的總質量一定是6.6g
D.當金屬全部溶解時,參加反應的硝酸的物質的量一定是0.4mol
查看答案和解析>>
科目:高中化學 來源:2010-2011學年四川省高三2月月考(理綜)化學部分 題型:選擇題
將一定量的鎂和銅組成的混合物加入到稀硝酸中,金屬完全溶解(假設反應中還原產物只有NO)。向反應后的溶液中加入3mol/L NaOH溶液至沉淀完全,測得生成沉淀的質量比原合金的質量增加5.1g。則下列敘述中不正確的是
A、當生成的沉淀量達到最大時,消耗NaOH溶液的體積V≥100mL
B、當金屬全部溶解時收集到NO氣體的體積一定為2.24L
C、參加反應的金屬的總質量為9.6g>m>3.6g
D、當金屬全部溶解時,參加反應的硝酸的物質的量一定是0.4mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com