

| 反應時間 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反應I 恒溫恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反應II 絕熱恒容 | 0min | 0 | 0 | 2 | 2 |
分析 Ⅰ、依據熱化學方程式和蓋斯定律計算所得熱化學方程式;
Ⅱ、(1)①自發進行的判斷依據是△H-T△S<0,結合反應特征分析判斷需要的條件;
②平衡標志是正逆反應速率相同,個組分含量保持不變,原則是變量不變分析選項;
③圖象t2起點,t3 到t4終點,t4以后符合變化趨勢即可,在t2時將容器容積縮小一倍,壓強增大,二氧化碳濃度增大,平衡正向進行,隨后減小,t3時達到平衡,t4時降低溫度,平衡正向進行,二氧化碳減小,反應速率減小,t5時達到平衡;
(2)①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0,反應Ⅰ是恒溫恒容容器,Ⅱ為恒容絕熱,反應是放熱反應,圖表中反應ⅠⅡ若恒溫恒容達到相同平衡狀態,Ⅱ為逆向恒容絕熱,溫度降低,平衡正向進行,平衡常數增大,甲醇濃度增大;
②反應速率V=$\frac{△c}{△t}$計算得到氫氣反應速率,速率之比等于化學方程式計量數之比計算甲醇反應速率;依據平衡三段式列式計算分析平衡狀態的物質的量.
解答 解:Ⅰ. 已知:H2的熱值為142.9KJ•g-1 ,燃燒熱為285.8KJ/mol,
①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol
②N2(g)+2O2(g)=2NO2(g)△H=+133kJ•mol-1
③H2O(g)=H2O(l)△H=-44kJ•mol-1
①×4-②-③×4得到催化劑存在下,H2還原NO2生成水蒸氣和其它無毒物質的熱化學方程式為4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1;
故答案為:4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJ•mol-1;
Ⅱ.(1)①CO2(g)+3H2(g)═CH3OH(l)+H2O(l),熵變△S<0,則反應焓變△H<0,低溫下滿足△H-T△S<0
故答案為:低溫;
②CO2(g)+3H2(g)═CH3OH(l)+H2O(l),
a、混合氣體的平均式量始終保持不變,不能說明反應達到平衡狀態,故a錯誤;
b、向2L密閉容器中加入2mol CO2、6mol H2,按照1:3反應,所以過程中CO2和H2的體積分數始終保持不變,故b錯誤;
c、向2L密閉容器中加入2mol CO2、6mol H2,按照1:3反應,CO2和H2的轉化率始終相等,不能確定反應是否達到平衡狀態,故c錯誤;
d、反應物是氣體,生成物是液體,混合氣體的密度保持不變,說明反應達到平衡狀態,故d正確;
e、1mol CO2生成的同時有3mol H-H鍵斷裂,說明正逆反應速率相同,反應達到平衡狀態,故e正確;
故答案為:de;
③在t2時將容器容積縮小一倍,壓強增大,二氧化碳濃度增大,平衡正向進行,隨后減小,t3時達到平衡,t4時降低溫度,平衡正向進行,二氧化碳減小,反應速率減小,t5時達到平衡;
圖象t2起點二氧化碳濃度突然增大為1mol/L,隨反應進行減小,圖中t3 到t4終點平衡線在0.5的線上,t4t4以后在0.5線以下,但不能到橫坐標線上且有平衡線段,圖象為: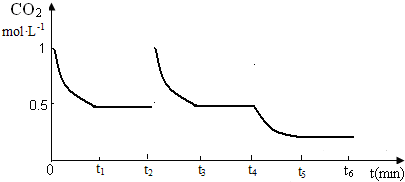 ;
;
故答案為:
(2)①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0,反應Ⅰ是恒溫恒容容器,Ⅱ為恒容絕熱,反應是放熱反應,圖表中反應ⅠⅡ若恒溫恒容達到相同平衡狀態,Ⅱ為逆向恒容絕熱,溫度降低,平衡正向進行,平衡常數增大,甲醇濃度增大;
故答案為:<,<;
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
起始量(mol) 2 6 0 0
變化量(mol) 1 3 1 1
30min量(mol) 1 3 1 1
對反應I,前10min內的平均反應速率v(CH3OH)=$\frac{1}{3}$V(H2)=$\frac{1}{3}$×(6-4.5)mol2L10min=0.025mol•L-1•min-1;
若30min時只改變溫度為T2℃,此時H2的物質的量為3.2mol,氫氣增加,說明平衡逆向進行,溫度升高T2>T1,
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
起始量(mol/L)1 3 0 0
變化量(mol/L)0.5 1.5 0.5 0.5
30min量(mol/L)0.5 1.5 0.5 0.5
濃度商Q1=$\frac{0.5×0.5}{0.5×1.{5}^{3}}$=$\frac{0.5}{1.{5}^{3}}$
若30min時只向容器中再充入1mol CO2(g)和1mol H2O(g),
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)
(mol/L)1 1.5 0.5 1
濃度商Q2=$\frac{1×0.5}{1×1.{5}^{3}}$=$\frac{0.5}{1.{5}^{3}}$=Q1,
所以平衡不移動;
故答案為:0.025mol•L-1•min-1 ,<,不.
點評 本題考查了熱化學方程式書寫,平衡影響因素分析判斷,平衡計算的分析應用,注意恒溫恒容和恒容絕熱容器的分析判斷,掌握基礎是關鍵,題目難度中等.


 綜合自測系列答案
綜合自測系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | X | Y |
| A | SO2 | NH3 |
| B | Cl2 | CO2 |
| C | NH3 | CO2 |
| D | SO2 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1,則H2的標準燃燒熱為-241.8 kJ•mol-1 | |
| B. | 若C(石墨,s)=C(金剛石,s)△H>0,則石墨比金剛石穩定 | |
| C. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1,則20.0g NaOH固體與稀鹽酸完全中和,放出28.7 kJ的熱量 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,則△H1>△H2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 可用澄清石灰水來區分二氧化碳和二氧化硫 | |
| B. | 用米湯檢驗食用加碘鹽(含KIO3)中含有碘元素 | |
| C. | 能使灼熱的CuO由黑變紅的氣體一定是H2 | |
| D. | 可用石蕊試液來鑒別鹽酸和NaOH |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 石墨和氯化鈉分別受熱熔化 | B. | 冰的融化和水的分解 | ||
| C. | NaCl和HCl溶于水 | D. | 干冰和碘的升華 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Ba(NO3)2+H2SO4═BaSO4↓+2HNO3 | B. | BaCl2+Na2SO4═BaSO4↓+2NaCl | ||
| C. | Ba(OH)2+K2SO4═BaSO4↓+2KOH | D. | Ba(OH)2+H2SO4═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 無色溶液中:Na+、MnO4-、CO32-、Cl- | |
| B. | 能使紫色石蕊試劑變紅的溶液中:OH-、K+、Ba2+、Na+ | |
| C. | 透明的酸性溶液中:Fe3+、Mg2+、Cl-、NO3- | |
| D. | pH=1的溶液中:NH4+、Fe2+、Cl-、NO3- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com