
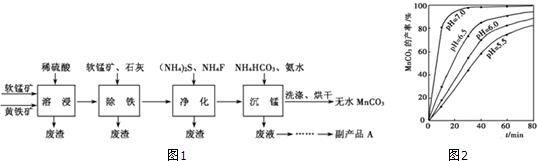
分析 (1)根據影響固體溶解的因素分析,提高溶浸工序中原料的浸出效率是為了加快固體溶解;
(2)根據得失電子守恒、原子守恒和電荷守恒分析配平書寫離子方程式,元素化合價變化,鐵元素從+2價變化為鐵離子,硫元素從-1價變化為+6價,二氧化錳做氧化劑,錳元素化合價從+4價變化為+2價,電荷守恒和原子守恒配平缺項物質和系數;
(3)根據MnCO3的產率與溶液pH、反應時間關系圖可知,pH值越大,MnCO3的產率越高;
(4)根據Ksp(CaF2)和c(F-),寫出溶度積常數表達式求算鈣離子濃度;
(5)根據MnCO3的產率與溶液pH、反應時間關系如圖分析,縱軸是碳酸錳的產率,橫軸為時間,不同PH時的產率變化曲線分析判斷,PH越大,產率越大,曲線越陡反應速率越大分析;
(6)根據溶液中含有的離子分析副產品的主要成分為銨鹽,可以做氮肥化肥.
解答 解:(1)加入石灰調節溶液的pH使鐵離子沉淀完全,在加入石灰調節溶液的pH前,加入適量的軟錳礦主要是使二價鐵離子氧化為鐵離子;
故答案為:使殘余Fe2+轉化為Fe3+;
(2)已知Ksp(CaF2))=1.46×10-10,c(F-)=0.01 mol•L-1 ,則c(Ca2+)=$\frac{Ksp}{{c}^{2}({F}^{-})}$=$\frac{1.46×1{0}^{-10}}{0.0{1}^{2}}$=1.46×10-6mol•L-1,
故答案為:1.46×10-6mol/L;
(3)根據MnCO3的產率與溶液pH、反應時間關系如圖可知:pH等于7.0時反應到達平衡所用時間最短,即反應速率最快,且MnCO3產率最高,
故答案為:pH等于7.0時反應速率最快,且MnCO3產率最高;
(4)溶浸過程中發生的反應生成硫酸根離子,后來又加入了硫化銨、碳酸氫銨,所以產品中含有(NH4)2SO4,可以做化肥;
故答案為:化肥等;
(5)FeS2與MnO2反應后生成Fe3+、Mn2+和SO42-,1molFeS2失去15mol電子,1molMnO2得到2mol電子,根據得失電子守恒,FeS2的計量數為2,MnO2的計量數為15,則生成的Fe3+計量數為2,SO42-的計量數為4,Mn2+的計量數為15,根據電荷守恒可知反應物中有H+,根據原子守恒可知生成物有H2O;所以離子方程式配平為:
2Fe2++15MnO2+28H+=2Fe3++14H2O+15Mn2++4SO42,
故答案為:2;15;28H+;2;15;4;14H2O;
(6)升高溫度、攪拌、減小固體的顆粒等均能加速固體的溶解,所以為了提高溶浸工序中原料的浸出效率,可以采取的措施有:適當升高溫度,攪拌,研磨礦石,適當提高稀硫酸的濃度;
故答案為:ABCD.
點評 本題以工業流程圖為依托,考查了化學式的計算、離子方程式的書寫、電極反應式等,題目難度較大,解題關鍵是合理分析題中生成流程及表中離子完全沉淀時的數據的含義,試題培養了學生分析、理解能力及靈活應用所學知識的能力.


科目:高中化學 來源: 題型:解答題
 乙烯的產量可以用來衡量一個國家的石油化工發展水平,這是因為乙烯能夠轉化為許多重要的有機化工原料,例如:
乙烯的產量可以用來衡量一個國家的石油化工發展水平,這是因為乙烯能夠轉化為許多重要的有機化工原料,例如: 、
、 .
. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 降低溫度將縮短反應達到平衡的時間 | |
| B. | 增大反應體系的壓強反應速率一定增大 | |
| C. | 催化劑V2O5同時改變正逆反應速率 | |
| D. | 增加O2的濃度將提高SO2的轉化率 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
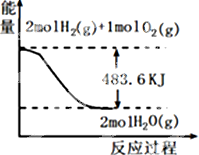
| A. | 表示1mol H2(g)完全燃燒生成水蒸氣吸收241.8 kJ熱量 | |
| B. | 表示的熱化學方程式為:H2(g)+$\frac{1}{2}$ O2(g)=H2O(g)△H=-241.8 kJ•mol-1 | |
| C. | H2O(g)的能量低于H2(g)和O2(g)的能量之和 | |
| D. | 表示2 mol H2(g)所具有的能量一定比2 mol氣態水所具有的能量多483.6 kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
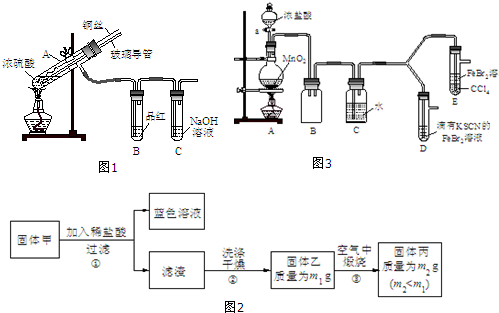
| 實驗操作 | 實驗現象 | 結論 |
| 打開活塞a,向圓底燒瓶中滴入適量濃鹽酸;然后關閉活塞a,點燃酒精燈. | D裝置中:溶液變紅 E裝置中:水層溶液變黃,振蕩后,CCl4層無明顯變化. | Cl2、Br2、Fe3+的氧化性由強到弱的順序為: Cl2>Br2>Fe3+ |
| ⅰ.(SCN)2性質與鹵素單質類似.氧化性:Cl2>(SCN)2. ⅱ.Cl2和Br2反應生成的BrCl呈紅色,沸點約5℃,與水發生水解反應. ⅲ.AgClO、AgBrO均可溶于水. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 除去保溫瓶中的水垢 | B. | 檢驗自來水中是否含有Cl- | ||
| C. | 檢驗買來的奶粉中是否加有淀粉 | D. | 洗去白色衣服上的番茄汁 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 它們的化學性質完全不同 | B. | 它們是碳元素的三種同位素 | ||
| C. | 它們是碳元素的三種單質 | D. | 它們是碳元素的同素異形體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 容器內壓強是開始時的1.5倍 | |
| B. | 容器內A、B、C物質的量濃度之比為2:2:1 | |
| C. | 單位時間消耗0.2 mol A 同時生成0.1 mol C | |
| D. | 容器內各物質的濃度不隨時間變化 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com