
四種短周期元素W、X、Y、Z,原子序數依次增大,請結合表中信息回答下列問題。
| W | X | Y | Z |
結構或性質 | 最高價氧化物對應的水化物與其氣態氫化物反應得到離子化合物 | 焰色反應呈黃色 | 在同周期主族元素形成的簡單離子中,離子半徑最小 | 最高正價與最低負價之和為零 |
(1)Z在元素周期表中位于 族。
(2)上述元素的最高價氧化物對應的水化物中,有一種物質在一定條件下均能與其他三種物質發生化學反應,該元素是 (填元素符號)。
(3)①下列可作為比較X和Y金屬性強弱的依據是 (填序號)。
A.自然界中的含量 B.單質與酸反應時失去的電子數
C.單質與水反應的難易程度 D.最高價氧化物對應水化物的堿性
②從原子結構的角度解釋X的金屬性強于Y的原因: ,原子半徑X>Y,所以原子核對最外層電子的吸引力X<Y,失電子能力X>Y。
(4)W的一種氫化物HW3可用于有機合成,其酸性與醋酸相似。體積和濃度均相等的HW3與X的最高價氧化物對應的水化物的溶液混合,反應的化學方程式是 。
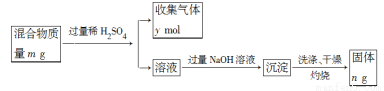
(5)Y單質和Mg組成的混合物是一種焰火原料,某興趣小組設計如下所示的實驗方案,測定混合物中Y的質量分數。能確定混合物中Y的質量分數的數據有 (填序號)。
A.m、n B.m、y C.n、y
(1)ⅣA (2)Na (3)①C D ②電子層數相同,質子數Y > X
(4)HN3+NaOH=NaN3+H2O (5)A B C
【解析】
試題分析:根據題意可推出W是N;X是Na;Y是Al ; Z 是Si 。(1)Si核外電子排布為2、8、4。所以它在元素周期表中位于第三周期第ⅣA。(2)上述元素的最高價氧化物對應的水化物中,有一種物質在一定條件下均能與其他三種物質發生化學反應,這種物質是NaOH。則該元素是Na。(3)①Na、Al都是金屬元素,可以通過其單質與水反應置換出氫的難易程度比較;也可以通過比較最高價氧化物對應水化物的堿性強弱。但不能看其原子失去電子的多少或自然界中的含量的多少。。因此選項為CD。②Na、Al都是第三周期的元素,原子核外的電子層數相同,但由于質數Al >Na。原子序數越大,原子半徑就越小,原子失去電子就越難,元素的金屬性就越弱。所以金屬性Na > Al。(4)HN3酸性與醋酸相似,則它是弱酸。酸堿中和生成鹽和水。則HN3與NaOH反應的方程式為HN3+NaOH=NaN3+H2O。(5) 有關反應的方程式為Mg+H2SO4=MgSO4+H2↑; 2Al+ 3H2SO4= Al2(SO4)3+ 3H2↑;當加足量的NaOH溶液時發生反應:AlCl3+4NaOH= NaAlO2+3NaCl+2H2O; MgSO4+2NaOH= Mg(OH)2↓+Na2SO4。得到的沉淀是Mg(OH)2.將其過濾、洗滌、干燥后灼燒發生分解反應得到MgO。Mg(OH)2 MgO+H2O。A.根據MgO的質量n可計算出其中的Mg元素的質量,再用Mg、Al的總質量減去Mg元素的質量即得到Al的質量,從而求出Al的質量分數。正確。B.假設Mg、Al的物質的量分別為a、b。則根據題意可得24a+27b=m;a+3/2b=y.兩式聯立就可計算出Al的物質的量,進而得出Al的質量,從而求出Al的質量分數。正確。C.根據MgO的質量n可計算出其中的Mg元素的質量,利用n=m/M計算出Mg的物質的量。根據Mg+H2SO4=MgSO4+H2↑知道其放出H2的物質的量。再用n(H2)(Al)=n(H2)(總)- n(H2)(Mg).根據2Al+ 3H2SO4= Al2(SO4)3+ 3H2↑可求出Al的物質的量,進而得出Al的質量,從而求出Al的質量分數。正確。
MgO+H2O。A.根據MgO的質量n可計算出其中的Mg元素的質量,再用Mg、Al的總質量減去Mg元素的質量即得到Al的質量,從而求出Al的質量分數。正確。B.假設Mg、Al的物質的量分別為a、b。則根據題意可得24a+27b=m;a+3/2b=y.兩式聯立就可計算出Al的物質的量,進而得出Al的質量,從而求出Al的質量分數。正確。C.根據MgO的質量n可計算出其中的Mg元素的質量,利用n=m/M計算出Mg的物質的量。根據Mg+H2SO4=MgSO4+H2↑知道其放出H2的物質的量。再用n(H2)(Al)=n(H2)(總)- n(H2)(Mg).根據2Al+ 3H2SO4= Al2(SO4)3+ 3H2↑可求出Al的物質的量,進而得出Al的質量,從而求出Al的質量分數。正確。
考點:考查元素的推斷、元素在周期表中的位置、元素的金屬性的比較、化學方程式的書寫及混合物中某成分的質量分數的計算的知識。


科目:高中化學 來源:2016屆山西省高一第二學期月考(一)化學試卷(解析版) 題型:選擇題
A、B為同主族的兩元素,A在B的上一周期,若A的原子序數為n,則B的原子序數不可能為
A.n+8 B.n+18 C.n+20 D.n+32
查看答案和解析>>
科目:高中化學 來源:2016屆山東省煙臺市高一上學期期末統考化學試卷(解析版) 題型:選擇題
下列有關溶液配制的敘述正確的是
A.將58.5g NaCl溶于1L水中可得1L 1.00mol·L-1 NaCl溶液
B.溶液定容時仰視容量瓶的刻度線,所得溶液的濃度偏大
C.定容搖勻后發現液面低于刻度線,需再加水至刻度線
D.容量瓶中原有少量的蒸餾水,不影響配制溶液的濃度
查看答案和解析>>
科目:高中化學 來源:2016屆山東省濰坊市高一上學期期末統考化學試卷(解析版) 題型:選擇題
下列物質間的每步轉化都能通過一步反應實現的是
①Fe→Fe2O3→Fe(OH)3 ② Na→Na2O2→Na2CO3
③ S→SO3→H2SO4→MgSO4 ④ C→CO→CO2→Na2CO3
A.①② B.③④ C.②④ D.①③
查看答案和解析>>
科目:高中化學 來源:2016屆山東省濰坊市高一上學期期末統考化學試卷(解析版) 題型:選擇題
用右圖所示裝置進行實驗,下列對實驗現象的解釋不合理的是
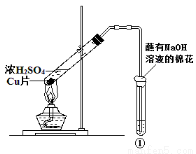
①中試劑①中現象解 釋
ABa(NO3)2溶液生成白色沉淀SO32-與Ba2+生成白色BaSO3沉淀
B品紅溶液溶液褪色SO2具有漂白性
C紫色石蕊溶液溶液變紅SO2與水反應生成酸
D酸性KMnO4溶液紫色褪去SO2具有還原性
查看答案和解析>>
科目:高中化學 來源:2016屆山東省濟寧市高一3月質檢化學試卷(解析版) 題型:選擇題
四種主族元素的離子aXm+、bYn+、cZn-和dRm-(a、b、c、d為元素的原子序數),它們具有相同的電子層結構,若m>n,則對下列敘述的判斷正確的是( )
①a-b=m-n
②元素的原子序數a>b>c>d
③元素非金屬性Z>R
④最高價氧化物對應水化物的堿性X>Y
A.②③ B.③ C.①②③④ D.①②③
查看答案和解析>>
科目:高中化學 來源:2016屆山東省濟寧市高一3月質檢化學試卷(解析版) 題型:選擇題
下列說法正確的是( )
A.原子的L層上的電子數為奇數的元素一定是主族元素
B.同一周期的ⅡA族和ⅢA族元素的原子序數之差一定為1
C.相鄰兩個周期的同一主族元素的原子序數之差等于上一周期所含元素種類
D.主族序數等于周期序數的元素一定為金屬元素
查看答案和解析>>
科目:高中化學 來源:2016屆山東省濟寧市高一12月質檢化學試卷(解析版) 題型:選擇題
氫化鈣可以作為生氫劑(其中CaH2中氫元素為-1價),反應方程式如下CaH2+2H2O=Ca(OH)2+2H2↑,其中水的作用是
A.既不是氧化劑也不是還原劑 B.是氧化劑
C.是還原劑 D.既是氧化劑又是還原劑
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com