
科學家利用淡水與海水之間含鹽量的差別發明了一種新型電池——水電池。
(1)用二氧化錳納米棒作電池正極可提高發電效率,這是利用納米材料的 特性,使之能與鈉離子充分接觸。
(2)水電池總反應可表示為:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,該電池的負極反應式為 。水電池工作時,Na+不斷向 極方向移動。
(3)水電池生成1 mol Na2Mn5O10轉移電子的物質的量為 。
(4)某溫度下,Fe(OH)3(s)、Mg(OH)2(s)分別在溶液中達到沉淀溶解平衡后,溶液中金屬陽離子的濃度與溶液pH的關系如右圖。請據右圖分析:

①該溫度下,溶度積常數的關系為:KSP[Fe(OH)3] KSP[Mg(OH)2](填“>”、“=”或“<”);
②如果在新生成的Mg(OH)2濁液中滴入足量的FeCl3溶液,振蕩后,白色沉淀會全部轉化為紅褐色沉淀,原因是 。
(1)較強的吸附能力或較大的表面積 (2分)
(2)Ag + Cl--e-=AgCl (3分,2倍計量數、加“↓”不扣分,產物寫Ag+不給分) 正(2分)
(3)2 mol(3分,單位錯漏扣1分) (4)① < (2分)
②Mg(OH)2濁液中存在沉淀溶解平衡(1分),Mg(OH)2(s)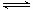 Mg2+(aq)+2OH-(aq),滴入足量的FeCl3溶液,c(Fe3+)×c3(OH―)>KSP[Fe(OH)3],Fe3+與OH-生成更難溶的Fe(OH)3(1分),使Mg(OH)2濁液沉淀溶解平衡向右移動(1分),Mg(OH)2 濁液轉化為Fe(OH)3沉淀(1分)。(注意要點,合理即給分)
Mg2+(aq)+2OH-(aq),滴入足量的FeCl3溶液,c(Fe3+)×c3(OH―)>KSP[Fe(OH)3],Fe3+與OH-生成更難溶的Fe(OH)3(1分),使Mg(OH)2濁液沉淀溶解平衡向右移動(1分),Mg(OH)2 濁液轉化為Fe(OH)3沉淀(1分)。(注意要點,合理即給分)
【解析】
試題分析:(1)由于納米材料的表面積大,具有很強的吸附能力,所以使之能與鈉離子充分接觸而提高發電效率。
(2)原電池中較活潑的金屬是負極,失去電子,發生氧化反應。電子經導線傳遞到正極,所以溶液中的陽離子向正極移動,正極得到電子,發生還原反應。根據總反應式5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl可知,Mn元素的化合價從+4價降低到+3.6價,得到電子做氧化劑。Ag元素的化合價從0價升高到+1價失去電子做還原劑。所以銀是負極,電極反應式為Ag + Cl--e-=AgCl。水電池工作時,陽離子Na+不斷向正極方向移動。
(3)Mn元素的化合價從+4價降低到+3.6價,所以水電池生成1 mol Na2Mn5O10轉移電子的物質的量為1mol×5×(4-3.6)=2mol。
(4)①根據圖像可知,在金屬陽離子的物質的量濃度相同的情況下,氫氧化鐵對應的pH小于氫氧化鎂對應的pH值,所以氫氧化鐵的溶度積常數小于氫氧化鎂的溶度積常數。
②由于Mg(OH)2濁液中存在沉淀溶解平衡Mg(OH)2(s)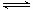 Mg2+(aq)+2OH-(aq),滴入足量的FeCl3溶液,當溶液中c(Fe3+)×c3(OH―)>KSP[Fe(OH)3]時,Fe3+與OH-生成更難溶的Fe(OH)3,使Mg(OH)2濁液的沉淀溶解平衡向右移動,從而使Mg(OH)2
濁液全部轉化為Fe(OH)3沉淀。
Mg2+(aq)+2OH-(aq),滴入足量的FeCl3溶液,當溶液中c(Fe3+)×c3(OH―)>KSP[Fe(OH)3]時,Fe3+與OH-生成更難溶的Fe(OH)3,使Mg(OH)2濁液的沉淀溶解平衡向右移動,從而使Mg(OH)2
濁液全部轉化為Fe(OH)3沉淀。
考點:考查納米材料的性質、電化學原理的應用與判斷以及溶度積常數的有關判斷與應用


科目:高中化學 來源: 題型:
 開發海洋,維持海洋的可持續發展是每個地球公民的神圣職責.請回答下面關于海洋的幾個問題:
開發海洋,維持海洋的可持續發展是每個地球公民的神圣職責.請回答下面關于海洋的幾個問題:查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源:2013-2014學年重慶市五區高三第一次學生學業調研抽測理綜化學試卷(解析版) 題型:填空題
水是生命之源,與人類的生活密切相關。在化學實驗和科學研究中,水有多種用途。
(1)下列說法中正確的是 (填序號)。
A.每一個水分子內含有兩個氫鍵
B.水分子間存在范德華力,所以水分子穩定
C.分子間形成的氫鍵使水的熔點和沸點升高
D.冰熔化時水分子內共價鍵發生斷裂
(2)科學家將水置于一個足夠強的電場中,在20℃時水分子瞬間凝固形成“暖冰”,則“暖冰”中水分子的空間構型為 。
(3)水分子在特定條件下易形成水合氫離子(H3O+)。其中含有的化學鍵為 。
(4)如果需要增大水的電離程度,除了升高溫度外,還可以采用的方法有 (回答一種即可)。若室溫時,將某一元酸HA加水配成0.1 mol·L-1的稀溶液,此時HA在水中有0.1%發生電離,則由HA電離出的c(H+)約為水電離出的c(H+)的 倍。
(5)將一定量的Na2SO3固體溶于水,所得溶液中的電荷守恒關系式為 。
(6)研究人員最近發現了一種“水”電池,這種電池能利用淡水與海水之間含鹽量差異進行發電。已知該電池用金屬銀做負極,正極反應為5MnO2 +2Na++2e- Na2Mn5O10,請寫出電池總反應式
。
Na2Mn5O10,請寫出電池總反應式
。
查看答案和解析>>
科目:高中化學 來源:2009-2010學年江蘇省揚州市高二(上)期末化學試卷(必修)(解析版) 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com