
A、B、C、D、E、F均為短周期主族元素,且原子序數依次增大。已知A的一種核素的質量數等于其質子數;E原子最外層電子數為其電子層數的兩倍,C、E是同主族元素;B的第一電離能大于C的第一電離能;D離子在同周期離子中半徑最小。G的最外層電子排布圖為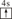 ,其余各能層電子全充滿。
,其余各能層電子全充滿。
(1)畫出B原子的結構示意圖____,G+離子的電子排布式為_____。
(2)C與E組成的一種化合物具有漂白性,該化合物分子中中心原子的VSEPR構型為 。
(3)D單質具有良好導熱性的原因是____。
(4)E、F的最高價氧化物對應的水化物的酸性強弱比較(填寫化學式):_____>_____。
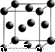
(5)G單質的晶胞結構如圖所示,則一個晶胞中G的原子個數為_____。
(6)A與B形成的10電子陽離子在重水中的水解離子方程式為____。
(1) ;1s22s22p63s23p63d10;(2)平面三角形;
;1s22s22p63s23p63d10;(2)平面三角形;
(3)在熱的作用下,自由電子與金屬鋁離子頻繁碰撞,形成熱的傳導;
(4)HClO4>H2SO4
(5)4; (6)NH4++D2O NH3·HDO+D+。
NH3·HDO+D+。
【解析】
試題分析:由題目提供的信息可知A為H;B為N;C為O;D為Al ; E 為S;F為Cl;G為Cu。(1)N原子的結構示意圖 。Cu+離子的電子排布式為1s22s22p63s23p63d10;(2)SO2具有漂白性,該化合物分子中中心原子的VSEPR構型為平面三角形。(3)金屬Al是由Al3+和自由電子構成的。當給某金屬加熱時,該區域的金屬陽離子和自由電子的能量都增大,自由電子的質量小,慣性小,運動速度快,當其運動碰撞其它金屬陽離子時,就把能量傳遞給該區域的金屬,自由電子與金屬鋁離子頻繁碰撞,形成熱的傳導;從而使整個金屬的溫度趨于一致,因此金屬具有良好導熱性。(4)元素的非金屬性Cl>S。元素的非金屬性越強,其最高價氧化物對應的水化物的酸性就越強。所以E、F的最高價氧化物對應的水化物的酸性強弱順序是HClO4>H2SO4;(5)一個晶胞中G的原子個數為8×1/8+6×1/2=4. (6)A與B形成的10電子陽離子為NH4+,在重水(D2O)中的水解離子方程式為NH4++D2O
。Cu+離子的電子排布式為1s22s22p63s23p63d10;(2)SO2具有漂白性,該化合物分子中中心原子的VSEPR構型為平面三角形。(3)金屬Al是由Al3+和自由電子構成的。當給某金屬加熱時,該區域的金屬陽離子和自由電子的能量都增大,自由電子的質量小,慣性小,運動速度快,當其運動碰撞其它金屬陽離子時,就把能量傳遞給該區域的金屬,自由電子與金屬鋁離子頻繁碰撞,形成熱的傳導;從而使整個金屬的溫度趨于一致,因此金屬具有良好導熱性。(4)元素的非金屬性Cl>S。元素的非金屬性越強,其最高價氧化物對應的水化物的酸性就越強。所以E、F的最高價氧化物對應的水化物的酸性強弱順序是HClO4>H2SO4;(5)一個晶胞中G的原子個數為8×1/8+6×1/2=4. (6)A與B形成的10電子陽離子為NH4+,在重水(D2O)中的水解離子方程式為NH4++D2O NH3·HDO+D+;
NH3·HDO+D+;
考點:考查元素的推斷、原子或離子的電子排布式、原子結構示意圖、金屬的性質、酸性強弱比較、Cu晶胞中原子個數的計算及鹽的水解的知識。


 學習實踐園地系列答案
學習實踐園地系列答案科目:高中化學 來源: 題型:閱讀理解
| 氟化物 | X | Y | Z |
| 熔點/K | 1266 | 1534 | 183 |
查看答案和解析>>
科目:高中化學 來源: 題型:
 [化學/選修/物質結構與性質]A、B、C、D、E五種短周期元素,原子序數依次增大,各元素對應的單質均為固體.A、C、E三元素的原子核外均只有2個未成對電子.B、E元素的原子序數之和等于C、D元素的原子序數之和.
[化學/選修/物質結構與性質]A、B、C、D、E五種短周期元素,原子序數依次增大,各元素對應的單質均為固體.A、C、E三元素的原子核外均只有2個未成對電子.B、E元素的原子序數之和等于C、D元素的原子序數之和.查看答案和解析>>
科目:高中化學 來源: 題型:
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com