
(1)分析如圖所示的三個裝置,回答下列問題:

①裝置a中鋁電極上的電極反應式為________________________。
②裝置b中產生氣泡的電極為________電極(填“鐵”或“銅”),裝置c中銅電極上的電極反應式為_____________________________________。
燃料電池是一種高效低污染的新型電池。燃料電池所用燃料可以是氫氣,也可以是其他燃料,如甲烷、肼等。
(2)如圖是甲烷燃料電池原理示意圖,回答下列問題:

①電池的負極是________(填“a”或“b”)電極,該極的電極反應式為:__________________。
②電池工作一段時間后電解質溶液的pH________(填“增大”“減小”或“不變”)。
(3)肼分子(H2N—NH2)可以在氧氣中燃燒生成氮氣和水,利用肼、氧氣與KOH溶液組成堿性燃料電池,請寫 出該電池反應的負極電極反應式______________________________。
出該電池反應的負極電極反應式______________________________。
科目:高中化學 來源:2015-2016學年天津一中高一下期末化學試卷(解析版) 題型:選擇題
氧化還原反應及鹽與酸或堿的復分解反應遵循“強制弱”的規律,個別反應不符合該規律。下列反應中屬于個別反應的是
A.2 Fe3++ Cu = 2Fe2+ + Cu2+
B.Cu2+ + H2S = CuS↓ + 2H+
C.Cl2 +2I- = 2Cl- + I2
D. Al3+ + 3NH3·H2O =Al(OH)3↓+ 3NH4+
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧莊河高中高二下期末化學試卷(解析版) 題型:推斷題
【化學——選修5:有機化學基礎】龍葵醛(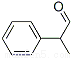 )是一種珍貴的香料,廣泛應用于香料、醫藥、染料及農藥等行業。以下是以苯為原料生成龍葵醛的一種合成路線(部分反應條件及副產物已略去):
)是一種珍貴的香料,廣泛應用于香料、醫藥、染料及農藥等行業。以下是以苯為原料生成龍葵醛的一種合成路線(部分反應條件及副產物已略去):
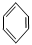
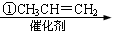

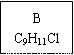

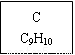
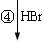
龍葵醛
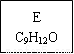

(1)龍葵醛的分子式為 ,其中含氧官能團的名稱是 ;A物質得到的1H-NMR譜中有
個吸收峰,B的結構簡式可能為 。
(2)反應③的反應類型為 ,反應⑤的反應條件為 。
(3)反應⑥的化學方程式為 。
(4)龍葵醛具有多種同分異構體,其中某些物質有下列特征:a.其水溶液遇FeCl3溶液呈紫色;b.苯環上的一溴代物有兩種;c.分子中沒有甲基。寫出符合上述條件的物質可能的結構簡式(只寫兩種):_________________________。
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧莊河高中高二下期末化學試卷(解析版) 題型:選擇題
X、Y、Z、M代表四種金屬元素.金屬X和Z用導線連接放入稀硫酸中時,X溶解,Z極上有氫氣放出;若電解Y2+和Z2+離子共存的溶液時,Y先析出;又知M2+離子的氧化性強于Y2+離子.則這四種金屬的活動性由強到弱的順序為( )
A.X>Y>Z>M B. X>Z>Y>M C. M>Z>X>Y D. X>Z>M>Y
查看答案和解析>>
科目:高中化學 來源:2015-2016學年遼寧莊河高中高二下期末化學試卷(解析版) 題型:選擇題
NA表示阿伏伽德羅常數,下列敘述正確的是( )
A.1mol FeI2與足量氯氣反應時轉移的電子數為2NA
B.2L 0.5mol•L﹣1硫酸鉀溶液中陰離子所帶電荷數為NA
C.1mol Na2O2固體中含離子總數為4NA
D.丙烯和環丙烷組成的42g混合氣體中氫原子的個數為6NA
查看答案和解析>>
科目:高中化學 來源:2015-2016學年吉林省松原市高一下期末化學試卷(解析版) 題型:選擇題
金屬(M)–空氣電池(如圖)具有原料易得、能量密度高等優點,有望成為新能源汽車和移動設備的電源。該類電池放電的總反應方程式為:4M+nO2+2n H2O=4M(OH) n。已知:電池的“理論比能量”指單位質量的電極材料理論上能釋放出的最大電能。下列說法正確的是
H2O=4M(OH) n。已知:電池的“理論比能量”指單位質量的電極材料理論上能釋放出的最大電能。下列說法正確的是
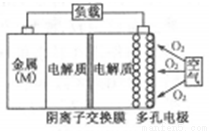
A.比較Mg、Al、Zn三種金屬–空氣電池,Mg–空氣電池的理論比能量最高
B.M–空氣電池放電過程的正極反應式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
C.采用多孔電極的目的是提高電極與電解質溶液的接觸面積,并有利于氧氣擴散至電極表面
D.在Mg–空氣電池中,為防止負極區沉積Mg(OH)2,宜采用酸性電解質及陽離子交換膜
查看答案和解析>>
科目:高中化學 來源:2015-2016學年吉林省松原市高一下期末化學試卷(解析版) 題型:選擇題
①②③④四種金屬片兩兩相連浸入稀硫酸中都可組成原電池。①②相連時,外電路電流從②流向①;①③相連時,③為正極;②④相連時,②上有氣泡逸出;③④相連時,③的質量減少。據此判斷這四種金屬活動性由大到小的順序是
A.①③②④ B.①③④② C.③④②① D.③①②④
查看答案和解析>>
科目:高中化學 來源:2015-2016學年吉林省松原市高二下期末化學試卷(解析版) 題型:簡答題
某廢水中可能含有下列離子中的若干種:Fe3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-。現進行如下實驗:
Ⅰ.取少量溶液,加入KSCN溶液,無明顯變化。
Ⅱ.另取溶液加入少量鹽酸,有無色氣體生成,該無色氣體遇空氣變成紅棕色。
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅳ.向Ⅱ中所得的溶液中加入過量濃氨水,僅有紅褐色沉淀生成。過濾,在所得濾液中加入鹽酸至酸性時,再加入氫氧化鈉溶液,有藍色沉淀生成(提示:氫氧化銅可以溶解在過量的濃氨水中)。
請回答下列問題:
(1)該廢水中一定含有的離子是____________,一定不含的離子是_________。
(2)實驗Ⅱ中加入少量鹽酸生成無色氣體的離子方程式是_____________________________。
(3)過濾除去Ⅳ中的藍色沉淀,調 整濾液的pH為10.7左右時,加入鋁粉,反應產生氨氣和氮氣的體積比為1∶4,其離子方程式為Al+NO3-
整濾液的pH為10.7左右時,加入鋁粉,反應產生氨氣和氮氣的體積比為1∶4,其離子方程式為Al+NO3- +OH-→AlO2-+NH3+N2+H2O(未配平)。該反應中還原產物是___
+OH-→AlO2-+NH3+N2+H2O(未配平)。該反應中還原產物是___ _____。若除去0.2 mol NO3-,要消耗鋁________g。
_____。若除去0.2 mol NO3-,要消耗鋁________g。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com