
【題目】常溫下,二甲胺[(CH3)2NH·H2O]是一元弱堿,其電離常數Kb=1.6×10-4。10 mL c mol·L-1二甲胺溶液中滴加0.1mo1·L-1鹽酸,混合溶液的溫度與鹽酸體積的關系如圖所示。下列說法不正確的

A. 二甲胺溶液的濃度為0.2mol·L-1
B. 在Y和Z點之間某點溶液pH=7
C. Y點存在:c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-)
D. 常溫下,(CH3)2NH2Cl水解常數Kh≈5.0×10-11
【答案】B
【解析】
A、溶液溫度最高,即Y點表示酸堿恰好完全反應;
B、二甲胺是弱堿,Y點對應溶質是強酸弱堿鹽,其溶液呈酸性,X點對應的溶液中(CH3)2NH·H2O、(CH3)2NH2Cl的濃度相等,其混合溶液呈堿性,故中性點應在X點與Y點之間;
C、二甲胺是弱堿,Y點對應溶質是強酸弱堿鹽,其溶液呈酸性;
D、Kh=Kw/Kb=1×10-14/1.6×10-4≈5.0×10-11;
A、二甲胺與鹽酸恰好完全中和時放出熱量最多,溶液溫度最高,即Y點表示酸堿恰好完全反應。根據(CH3)2NH·H2O+HCl=(CH3)2NH2Cl+H2O,c=0. 2mol·L-1,故A項正確;
B、二甲胺是弱堿,Y點對應溶質是強酸弱堿鹽,其溶液呈酸性,X點對應的溶液中(CH3)2NH·H2O、(CH3)2NH2Cl的濃度相等,其混合溶液呈堿性,故中性點應在X點與Y點之間,故B錯誤;
C、二甲胺是弱堿,Y點對應溶質是強酸弱堿鹽,其溶液呈酸性,Y點存在:c(Cl-)>c[(CH3)2NH2+]>c(H+)>c(OH-),故C正確;
D、Kh=Kw/Kb=1×10-14/1.6×10-4≈5.0×10-11,故D正確;
故選B。


 期末沖刺100分創新金卷完全試卷系列答案
期末沖刺100分創新金卷完全試卷系列答案科目:高中化學 來源: 題型:
【題目】決定物質性質的重要因素是物質結構。請回答下列問題:
(1)已知元素M是組成物質Ca5(PO4)3F的一種元素。元素M的氣態原子逐個失去第1個至第5個電子所需能量(即電離能,用符號I1至I5表示)如表所示:
I1 | I2 | I3 | I4 | I5 | |
電離能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合態常見化合價是_________價,其基態原子電子排布式為_________。
(2)Ca3(PO4)3F中非金屬元素電負性由大到小的順序為_________。
(3)PO43-的中心原子的雜化方式為_________,該離子的空間構型為_________,鍵角為________,其等電子體有_________ (請寫出兩種)。
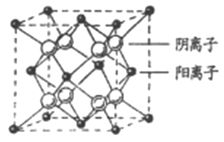
(4)CaF2晶胞結構如圖所示,則CaF2晶體中與Ca2+最近且等距離的Ca2+數目為_________;已知Ca2+和F半徑分別為a cm、b cm,阿伏加德羅常數為NA,M為摩爾質量,則晶體密度為________g·cm3(不必化簡)。
(5)已知MgO與CaO的晶體結構相似,其摩氏硬度的大小關系為_________,原因為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】aL體積比為1∶3的A、B兩種鏈烴的混合氣體,可與0.5aL(狀態相同)氫氣發生加成反應,則A、B兩種鏈烴的通式可能是( )
A. CnH2n-2和CnH2n+2B. C nH2n和CnH2n+2
C. CnH2n和CnH2nD. CnH2n和CnH2n-2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA代表阿伏加德羅常數的值。下列有關說法正確的是

A. 1L0.1mol·L-1 NaHSO3溶液中含S原子的粒子個數為0.1NA
B. 標準狀況下,6.72LNO2通入足量水中充分反應,轉移電子數為0.6NA
C. 28gN4(如圖所示)含N一N鍵數目為2NA
D. 1L0.5mol·L-1pH=7的CH3 COONH4溶液中NH4+數目為0.5NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容器中,將一定量A、B氣體混合后發生反應:xA(g)+yB(g)![]() zC(g)+mD(s)。平衡時測得A的濃度為0.5mol/L,保持溫度不變,將容器的容積擴大到原來的兩倍,再達平衡時,測得A的濃度為0.3 mol·L-1。則下列有關判斷正確的是 ( )
zC(g)+mD(s)。平衡時測得A的濃度為0.5mol/L,保持溫度不變,將容器的容積擴大到原來的兩倍,再達平衡時,測得A的濃度為0.3 mol·L-1。則下列有關判斷正確的是 ( )
A. B的轉化率一定減小 B. x+y>z+m
C. 平衡向正反應方向移動 D. 混合氣體的密度一定減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】相同體積、相同pH的某一元強酸溶液①和某一元中強酸溶液②分別與足量的鋅粉發生反應,下列關于氫氣體積(V)隨時間(t)變化的示意圖正確的是( )

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為將含有的FeCl3、FeCl2、CuCl2的廢液中的Cu2+還原回收,某同學在含有ag鐵粉的容器中加入廢液,探究了加入廢液體積與完全反應后體系中固體質量的關系,部分實驗數據如下表所示。已知:廢液中c(Cu2+)=0.7 mol·Lˉ1;廢液體積大于0.5L,充分反應后才能檢測出Cu2+。

下列說法不正確的是
A. 當鐵粉與0.25L廢液反應完全后,固體成分為Fe與Cu
B. 當鐵粉與1L廢液反應完全后,再加入廢液時發生的離子反應為Fe +2Fe3+=3Fe2+
C. 廢液中c(Fe3+)=0.2 mol·Lˉ1
D. 要將1L廢液中的Cu2+全部還原,則至少需要鐵粉44.8g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】當溫度高于 500 K 時,科學家成功利用二氧化碳和氫氣合成了乙醇,這在節能減排、降低碳排放方面具有重大意義。
(1)該反應的化學方程式為________________;其平衡常數表達式為K=________。
(2)在恒容密閉容器中,判斷上述反應達到平衡狀態的依據是________。
a.體系壓強不再改變 b.H2的濃度不再改變 c.氣體的密度不隨時間改變 d.單位時間內消耗 H2和 CO2的物質的量之比為 3∶1
(3)已知:1 g 氫氣完全燃燒生成液態水,放出 143 kJ 熱量;23 g 乙醇完全燃燒生成液態水和二氧化碳,放出 650 kJ 熱量,則氫氣和乙醇的燃燒熱的比值為________。(要求計算出數值)
(4)在一定壓強下,測得由 CO2制取 CH3CH2OH 的實驗數據中,起始投料比、溫度與 CO2的轉化率的關系如圖所示,根據圖中數據

①降低溫度,平衡向________方向移動。
②在 700 K、起始投料比 n(H2)/n(CO2)=1.5 時,H2的轉化率為________。
③在 500 K、起始投料比n(H2)/n(CO2)=2 時, 達到平衡后 H2的濃度為a mol·L-1,則達到平衡時 CH3CH2OH 的濃度為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗操作中,不合理的是( )

A. 洗滌沉淀時(如圖①),向漏斗中加適量水,攪拌并濾干
B. 用CCl4提取碘水中的碘,選③
C. 蒸餾時蒸餾燒瓶中液體的體積不能超過容積的2/3,液體也不能蒸干
D. 粗鹽提純,選①和②
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com