某學生用0.20mol/L KOH溶液滴定未知濃度的鹽酸溶液(指示劑為酚酞).請回答下列問題:

(1)如圖1表示50mL滴定管中液面的位置,若A與C刻度間相差1mL,A處的刻度為25,滴定管中液面讀數應為
25.40
25.40
mL;反應達滴定終點時的現象為
錐形瓶中溶液的顏色由無色變淺紅,且在半分鐘內不褪色
錐形瓶中溶液的顏色由無色變淺紅,且在半分鐘內不褪色
.
(2)排去堿式滴定管中氣泡的方式應采用操作(如圖2所示)中的
丙
丙
,然后輕輕擠壓玻璃球使尖嘴部分充滿堿液.
(3)為減小實驗誤差,該同學一共進行了三次實驗,假設每次所取待測液體積均為20.00mL,三次實驗結果記錄如下:
| 滴定次數 |
待測液體積 |
標準KOH溶液體積/ml |
滴定前讀數/ml |
滴定后讀數/ml |
第一次 |
20.00 |
0.02 |
25.00 |
第二次 |
20.00 |
0.01 |
25.03 |
第三次 |
20.00 |
0.03 |
26.35 |
根據上述數據可以計算出鹽酸的物質的量濃度為
0.25 mol/L
0.25 mol/L
.(保留兩位有效數字)
(4)實驗過程中,下列操作將造成待測鹽酸溶液濃度偏高的是
B D
B D
.
A.實驗結束時,俯視刻度線讀取滴定終點時KOH溶液的體積;
B.滴定前滴定管尖嘴有氣泡,滴定結束尖嘴部分充滿溶液;
C.量取待測液的滴定管沒有用待測液潤洗;
D.錐形瓶水洗后又用待測液潤洗;
E.滴加NaOH溶液時,未充分振蕩,剛看到溶液變色,立刻停止滴定.




 導學教程高中新課標系列答案
導學教程高中新課標系列答案 小學課時特訓系列答案
小學課時特訓系列答案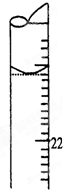 某學生用0.1000mol?L-1標準氫氧化鈉溶液滴定未知濃度的鹽酸溶液,其操作可分解為如下幾步:
某學生用0.1000mol?L-1標準氫氧化鈉溶液滴定未知濃度的鹽酸溶液,其操作可分解為如下幾步: