
| A. | 用鍍錫鐵做罐頭盒,當鍍層破壞后錫能對鐵提供保護 | |
| B. | 用銅作電極電解稀硫酸,發生反應:Cu+H2SO4$\frac{\underline{\;通電\;}}{\;}$CuSO4+H2↑ | |
| C. | 某原電池的電極材料分別為Mg和Al,則Mg一定做負極 | |
| D. | 某可逆反應升高溫度,活化能大的方向化學反應速率增大程度小 |
分析 A、錫的金屬性小于鐵、鋅的金屬性大于鐵,所以鍍層破損后?形成原電池,鍍錫鐵更容易被腐蝕;
B、金屬銅是活潑電極,電解硫酸溶液在陰極上是硫酸中的氫離子發生得電子的還原反應;
C、在原電池中,發生失電子氧化反應的電極是負極;
D、正逆反應的活化能大小是相同的.
解答 解:A、鍍錫鐵桶和鍍鋅鐵桶在鍍層破損后,鐵和錫、鐵和鋅構成了原電池,其中鍍錫的鐵桶中,鐵為原電池的負極,更容易被腐蝕,故A錯誤;
B、用銅作電極電解稀硫酸,金屬銅是活潑電極,電解硫酸溶液在陰極上是硫酸中的氫離子發生得電子的還原反應,發生總反應為Cu+H2SO4$\frac{\underline{\;通電\;}}{\;}$CuSO4+H2↑,故B正確;
C、原電池的電極材料分別為Mg和Al,若是氫氧化鈉作電解質,此則Mg不做負極,做正極,故C錯誤;
D、可逆反應升高溫度,吸熱方向化學反應速率增大程度大,故D錯誤.
故選B.
點評 本題涉及金屬的腐蝕和防護、電解池的工作原理以及原電池的構成、溫度對反應速率的影響等方面知識,屬于綜合知識的考查,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. |  除去粗鹽溶液中的不溶物 | B. | 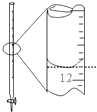 記錄滴定終點讀數為12.20ml | ||
| C. | 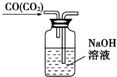 除去CO氣體中的CO2氣體 | D. | 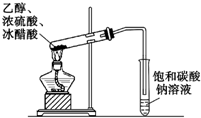 乙酸乙酯制備演示實驗 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②③④⑤ | B. | ①③④⑥ | C. | ①②③④⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
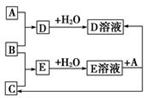 已知A、B、C為中學化學中常見的單質.室溫下,A為固體,B和C均為氣體.在適宜的條件下,它們可以按如圖框圖進行反應.
已知A、B、C為中學化學中常見的單質.室溫下,A為固體,B和C均為氣體.在適宜的條件下,它們可以按如圖框圖進行反應.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原電池是將電能轉變為化學能的裝置 | |
| B. | 原電池陽極發生氧化反應 | |
| C. | 電解池陰極發生還原反應 | |
| D. | 電解池的陰極連接電源正極 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②④①③ | B. | ③④①② | C. | ①②④③ | D. | ②①④③ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 氫氧化鈉質量(g) | 氯化鈉質量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com