
【題目】Ⅰ.實驗室欲用質量分數為36.5%的濃鹽酸(密度為![]() )來配制
)來配制![]() 稀鹽酸。請回答下列問題:
稀鹽酸。請回答下列問題:
(1)需要用到的儀器除量筒燒杯外,還需用到的儀器有_________。
(2)在上述儀器選定的情況下,需要量取濃鹽酸________![]() 。
。
(3)對于容量瓶來說除洗凈外還必須進行的一項操作是_____________。
(4)配制溶液過程中,下列操作對溶液中溶質的物質的量濃度有何影響?(在橫線上填“偏高”“偏低”或“無影響”)
①燒杯和玻璃棒洗凈后沒有烘干即進行實驗:________________。
②溶解液轉移后沒有用蒸餾水洗滌燒杯2~3次:________________。
③定容時,俯視刻度線:__________________。
Ⅱ.取出配制好的鹽酸![]() 與足量的鋅粒反應。試計算:
與足量的鋅粒反應。試計算:
(5)產生的氫氣在標準狀況下的體積為_________![]() 。
。
(6)轉移的電子的物質的量為__________。
【答案】膠頭滴管、![]() 容量瓶、玻璃棒 25.0 檢查是否漏液 無影響 偏低 偏高 134.4
容量瓶、玻璃棒 25.0 檢查是否漏液 無影響 偏低 偏高 134.4 ![]()
【解析】
Ⅰ.(1)配制一定物質的量濃度的溶液需要用到的儀器是量筒(天平)、燒杯、一定規格的容量瓶、膠頭滴管、玻璃棒,故答案為:膠頭滴管、![]() 容量瓶、玻璃棒;
容量瓶、玻璃棒;
(2)![]() 稀鹽酸的物質的量為
稀鹽酸的物質的量為![]() ,
,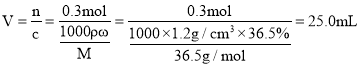 ,故答案為:
,故答案為:![]() ;
;
(3)容量瓶使用前必須檢驗是否漏液,故答案為:檢查是否漏液;
(4)①燒杯和玻璃棒洗凈后沒有烘干對實驗無影響,故答案為:無影響;
②溶解液轉移后沒有用蒸餾水洗滌燒杯2~3次,導致溶質物質的量減小,所配溶液的濃度偏低,故答案為:偏低;
③定容時,俯視刻度線,體積偏小,所配溶液的濃度偏高,故答案為:偏高;
Ⅱ.(5)![]() 鹽酸的物質的量為
鹽酸的物質的量為![]() ,根據反應方程式:
,根據反應方程式:![]() ↑,所生成的氫氣的物質的量為
↑,所生成的氫氣的物質的量為![]() ,
,![]() ,故答案為:134.4;
,故答案為:134.4;
(6)生成![]() ,轉移
,轉移![]() ,則生成
,則生成![]() ,轉移
,轉移![]() ,故答案為:
,故答案為:![]() 。
。


科目:高中化學 來源: 題型:
【題目】圖甲為一種新型污水處理裝置,該裝置可利用一種微生物將有機廢水的化學能直接轉化為電能。圖乙為電解氯化銅溶液的實驗裝置的一部分。下列說法中正確的是

A. a極要與Y極連接
B. N電極發生還原反應,當N電極消耗5.6L(標準狀況下)氣體時,則a電極增重64g
C. 不論b為何種電極材料,b極的電極反應式一定為2C1--2e-=Cl2↑
D. 若有機廢水中主要含有乙醛,則圖甲中M極發生的電極應為:CH3CHO+3H2O-l0e-=2CO2↑+l0H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中不正確的有( )個
①反應速率用于衡量化學反應進行的快慢
②可逆反應達到化學平衡狀態時,正、逆反應速率都為0
③決定反應速率的主要因素是反應物的性質
④適當增大反應物濃度,提高反應溫度都能增大反應速率
⑤不管什么反應使用催化劑,都可以加快反應速率 ,并可以使平衡移動。
⑥可逆反應A(g)![]() B(g)+C(g),增大壓強,正反應速率減小,逆反應速率增大
B(g)+C(g),增大壓強,正反應速率減小,逆反應速率增大
⑦對達到平衡的一個放熱的可逆反應,若降溫,則正反應速率減小,逆反應速率增大
A. 2 個 B. 3 個 C. 4 個 D. 5個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據所學知識,回答下列問題:
(1)“元時,南安有黃長者,為宅煮糖,宅垣忽壞,去土而糖白,后人遂效之。”泥土能將紅糖變白糖,其表現的性質是__________。
(2)用雞蛋殼膜和蒸餾水可除去淀粉膠體中的食鹽,其原理是______________。
(3)欲使![]() 全部轉化為
全部轉化為![]() ,則需要氧化劑
,則需要氧化劑![]() (還原產物為
(還原產物為![]() )至少_______
)至少_______![]() 。
。
(4)下列變化為化學變化的是_________(填字母)。
A.![]() 的潮解 B.鐵的生銹 C.新制氯水久置后顏色變淺
的潮解 B.鐵的生銹 C.新制氯水久置后顏色變淺
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】掌握化學的基本概念和研究方法才能學好化學。按要求回答下列問題:
(1)下列是對堿、酸、鹽、氧化物的分類列表:
堿 | 酸 | 鹽 | 氧化物 | |
第一組 |
|
|
|
|
第二組 |
|
|
|
|
第三組 |
|
|
|
|
表中每組均有物質分類錯誤,三組中對應分類錯誤的物質分別是_________、_________、_________。(填化學式)
(2)![]() 固體不能導電,而
固體不能導電,而![]() 溶液可以導電,原因是_________________________。
溶液可以導電,原因是_________________________。
(3)依據下列兩個反應,按要求填空。
Ⅰ.![]()
Ⅱ.![]()
反應Ⅰ和反應Ⅱ中,![]() 只作氧化劑的反應是________(填“Ⅰ”或“Ⅱ”);反應Ⅱ中,每生成標準狀況下
只作氧化劑的反應是________(填“Ⅰ”或“Ⅱ”);反應Ⅱ中,每生成標準狀況下![]() ,反應中轉移________
,反應中轉移________![]() 電子;
電子;![]() 和
和![]() 都能使澄清石灰水變渾濁,請設計一種方法檢驗
都能使澄清石灰水變渾濁,請設計一種方法檢驗![]() 、
、![]() 混合氣體中的
混合氣體中的![]() :_____________。
:_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CH4-CO2催化重整不僅可以得到合成氣(CO和H2),還對溫室氣體的減排具有重要意義。回答下列問題:
(1)CH4-CO2催化重整反應為:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)ΔH。
2CO(g)+2H2(g)ΔH。
已知:C(s)+2H2(g)=CH4(g)ΔH=-75kJ·mol1
C(s)+O2(g)=CO2(g)ΔH=-394kJ·mol1
C(s)+![]() O2(g)=CO(g)ΔH=-111kJ·mol1
O2(g)=CO(g)ΔH=-111kJ·mol1
該催化重整反應的ΔH=________kJ·mol1。有利于提高CH4平衡轉化率的條件是____(填標號)。
A.高溫低壓B.低溫高壓C.高溫高壓D.低溫低壓
某溫度下,在體積為2L的容器中加入2molCH4、1molCO2以及催化劑進行重整反應,達到平衡時CO2的轉化率是50%,其平衡常數為___________________________。
素材1:研究人員研制出一種鋰水電池,可作為魚雷和潛艇的儲備電源。該電池以金屬鋰和鋼板為電極材料,以LiOH為電解質,使用時加入水即可放電。總反應為:2Li+2H2O===2LiOH+H2↑。根據以上素材回答下列問題:
(2)該電池的負極是________,負極反應式是_____________________________。
(3)正極現象是_______________________________________________。
(4)放電時OH-向_____________(填“正極”或“負極”)移動。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硅材料在工業生產中具有重要的應用,下列說法正確的是( )
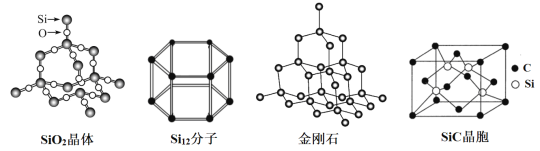
A.熔沸點比較:金剛石<SiC
B.SiC中Si原子的配位數為4
C.Si12與單晶硅互為同分異構體
D.1molSiO2中含有2molSi-O鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子反應方程式正確的是
A. 實驗室用固體氯化銨和熟石灰共熱制取NH3:2NH4++Ca(OH)2![]() 2NH3↑+ Ca2++2H2O
2NH3↑+ Ca2++2H2O
B. 銅與濃硝酸反應: 3Cu + 8H+ + 2NO3-=3Cu2+ + 2NO↑ + 4H2O
C. 氨水與FeCl3溶液反應:3OH-+ Fe3+ =Fe(OH)3↓
D. Na2O2投入水中:2Na2O2+2H2O = 4Na++4OH-+O2↑
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com