
【題目】向Cu和CuO的混合物中加入0.6 L2.0 mol/L的稀硝酸,混合物完全溶解,同時生成標準狀況下NO 4.48 L。向所得溶液中加入一定體積1.0 mol/L NaOH溶液,恰好使Cu2+完全沉淀,將沉淀洗滌,充分灼燒后得32.0 g固體。求:
(1)混合物中Cu的質量是____________。
(2)混合物消耗HNO3的物質的量是____________。
(3)NaOH溶液的體積是____________。
(4)Cu2+完全反應后,溶液中NO3-的物質的量濃度是____________。
【答案】19.2 g 1 mol 1000 mL 0.625 mol/L
【解析】
(1)計算出標況下4.48LNO的物質的量,根據電子守恒計算出混合物中銅的物質的量,再根據m=nM計算出銅的質量;
(2)最終得到的固體為氧化銅,根據n=![]() 計算出氧化銅的物質的量;反應消耗的硝酸為生成硝酸銅和生成NO所消耗的,根據N原子守恒計算出消耗硝酸的物質的量;
計算出氧化銅的物質的量;反應消耗的硝酸為生成硝酸銅和生成NO所消耗的,根據N原子守恒計算出消耗硝酸的物質的量;
(3)銅離子完全沉淀時,溶質為硝酸鈉,根據溶液中硝酸根離子的物質的量計算出氫氧化鈉的物質的量;
(4)根據c=![]() 計算氫氧化鈉的濃度、硝酸根離子濃度,據此進行計算。
計算氫氧化鈉的濃度、硝酸根離子濃度,據此進行計算。
(1)標況下4.48LNO的物質的量為:![]() =0.2mol,根據電子守恒,原混合物中含有銅的物質的量為:n(Cu)=
=0.2mol,根據電子守恒,原混合物中含有銅的物質的量為:n(Cu)=![]() =0.3mol,其質量為:64g/mol×0.3mol=19.2g;
=0.3mol,其質量為:64g/mol×0.3mol=19.2g;
(2)最終得到的32.0g為氧化銅,氧化銅的物質的量為:![]() =0.4mol,根據銅原子守恒可知,原混合物中含有CuO的物質的量為:0.4mol0.3mol=0.1mol,與該混合物反應的硝酸反應后生成硝酸銅和NO,根據氮原子守恒,消耗硝酸的物質的量為:0.4mol×2+0.2mol=1mol;
=0.4mol,根據銅原子守恒可知,原混合物中含有CuO的物質的量為:0.4mol0.3mol=0.1mol,與該混合物反應的硝酸反應后生成硝酸銅和NO,根據氮原子守恒,消耗硝酸的物質的量為:0.4mol×2+0.2mol=1mol;
(3)0.6L2.0mol/L稀硝酸中含有硝酸的物質的量為:2.0mol/L×0.6L=1.2mol,向所得溶液中加入一定體積1.0mol/LNaOH溶液,恰好使Cu2+沉淀完全,此時溶質為硝酸鈉,反應后溶液中硝酸根離子的物質的量為:1.2mol0.2mol=1.0mol,根據鈉原子守恒,消耗氫氧化鈉的物質的量為1.0mol,消耗氫氧化鈉溶液的體積為:![]() =1L=1000mL;
=1L=1000mL;
(4)銅離子完全沉淀時,根據(3)可知,硝酸根離子的物質的量為1mol,濃度為:![]() =0.625mol/L。
=0.625mol/L。


 新思維假期作業暑假吉林大學出版社系列答案
新思維假期作業暑假吉林大學出版社系列答案科目:高中化學 來源: 題型:
【題目】常溫下,將鹽酸滴加到Na2X溶液中,混合溶液的pOH[pOH=—lgc(OH-)]與離子濃度變化的關系如圖所示。
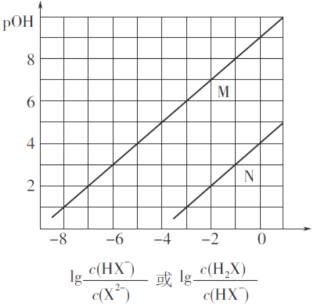
下列敘述正確的是
A. 曲線N表示pOH與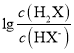 兩者的變化關系
兩者的變化關系
B. NaHX溶液中c(X2-)>c(H2X)
C. 當混合溶液呈中性時,c(Na+)=c(HX-)+2c(X2-)
D. 常溫下,Na2X的第一步水解常數Kh1=1.0×10-4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在密閉容器里,通入x mol H2(g)和y mol I2(g),發生反應:H2(g)+I2(g)![]() 2HI(g) △H<0。達到平衡后,改變下列條件,反應速率將如何改變 (填“增大”“減小”或“不變”)?平衡將如何移動(填“向左”“向右”或“不變”)?
2HI(g) △H<0。達到平衡后,改變下列條件,反應速率將如何改變 (填“增大”“減小”或“不變”)?平衡將如何移動(填“向左”“向右”或“不變”)?
(1)升高溫度,反應速率將_________,平衡將如何移動 ;
(2)加入正催化劑,反應速率將_________,平衡將如何移動 ;
(3)充入更多的H2,反應速率將_________,平衡將如何移動 ;
(4)擴大容器的體積,反應速率將_________,平衡將如何移動 ;
(5)容器體積不變,通入氖氣,反應速率將___________,平衡將如何移動 ;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】材料是人類文明進步的階梯,第ⅢA、ⅣA、VA及Ⅷ族元素是組成特殊材料的重要元素。
回答下列問題:
(1)基態硼核外電子占據的最高能級的電子云輪廓圖形狀為____。與硼處于同周期且相鄰的兩種元素和硼的第一電離能由大到小的順序為___。
(2)某元素位于第四周期Ⅷ族,其基態原子的未成對電子數與基態氮原子的未成對電子數相同,則其基態原子的價層電子排布式為____。
(3)NH3能與眾多過渡元素離子形成配合物,向CuSO4溶液中加入過量氨水,得到深藍色溶液,向其中加人乙醇析出深藍色晶體,加入乙醇的作用____,該晶體的化學式為_____。
(4)銅與(SCN)2反應生成Cu(SCN)2,1 mol(SCN)2中含有π鍵的數目為_____,HSCN結構有兩種,硫氰酸(H-S-C≡N)的沸點低于異硫氰酸(H-N=C=S)的原因是_______。
(5)MgCO3的熱分解溫度_____(填“高于”或“低于”)CaCO3的原因是________。
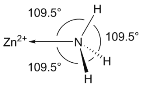
(6)NH3分子在獨立存在時H-N-H鍵角為107°。如圖是[Zn(NH3)6]2+離子的部分結構以及H-N-H鍵角的測量值。解釋NH3形成如圖配合物后H-N-H鍵角變大的原因:_________。
(7)某種金屬鋰的硼氫化物是優質固體電解質,并具有高儲氫密度。陽離子為Li+,每個陰離子是由12個硼原子和12個氫原子所構成的原子團。陰離子在晶胞中位置如圖所示,其堆積方式為_____,Li+占據陰離子組成的所有正四面體中心,該化合物的化學式為_____(用最簡整數比表示)。假設晶胞邊長為anm,NA代表阿伏伽德羅常數的值,則該晶胞的密度為________g/cm3。(用含a,NA的代數式表示)

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三氧化鉻(CrO3)又叫鉻酸酐,是一種暗紅色固體,溶于水會生成鉻酸(H2CrO4),200℃以上會部分分解生成氧化鉻(Cr2O3)。
I.下圖是用鉻鐵礦(主要成分是FeCr2O4,含A12O3、SiO2等雜質)生產CrO3的傳統工藝流程,請回答相關問題。
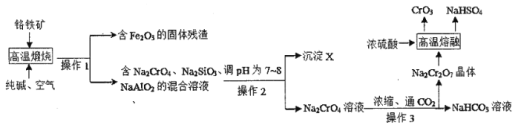
(1)操作1的名稱是____,沉淀X的成分是_____(填化學式)。
(2)高溫煅燒時FeCr2O4參與反應的化學方程式是____。
II.某工廠采用了一種新的生產CrO3的工藝流程,與傳統工藝流程主要區別如下圖所示(中間過程省略)。
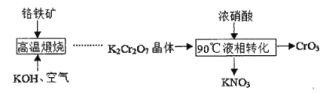
(3)液相轉化過程發生反應的化學方程式是____。
(4)新工藝與傳統工藝相比有多種優點:可得到價值更高的副產品KNO3;___;從綠色化學角度考慮新工藝也存在某種缺點,該缺點是____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某澄清透明溶液可能含有Na+、Cl-、CO32-、SO42-、Mg2+、NH4+中的幾種,進行如下實驗:將上述溶液分為兩等份,其中一份滴加足量的BaCl2溶液,得到白色沉淀4.66g;另一份溶液中滴加足量的NaOH溶液,得到0.58g白色沉淀,加熱后產生標準狀況下的氣體0.224L,該氣體能使濕潤的紅色石蕊試紙變藍色。下列說法正確的是( )
A.溶液中可能有Na+、Cl-
B.溶液中一定沒有Cl-、CO32-
C.溶液中一定有Na+、SO42-、Mg2+、NH4+
D.溶液中是否存在Na+只能用焰色反應確認
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知溶液中的化學反應大多是離子反應。根據要求回答下列問題。
(1)水存在如下平衡:H2O+H2O![]() H3O++OH-,向水中加入NaHSO4固體,水的電離平衡向________(填 “左”或“右”)移動, 且所得溶液顯____ 性。
H3O++OH-,向水中加入NaHSO4固體,水的電離平衡向________(填 “左”或“右”)移動, 且所得溶液顯____ 性。
(2)向水中加NaHCO3固體,水的電離平衡向____(填“左”或“右”)移動,且所得溶液顯____ 性。
(3)常溫下,0.1 mol·L-1 CH3COONa溶液的pH為9,則由水電離出的c(H+)=________。
(4)若取pH、體積均相等的NaOH溶液和氨水分別加水稀釋m倍、n倍后pH仍相等,則m____n ( 填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度時,BaSO4在水中的沉淀溶解平衡曲線如圖所示。已知:p(Ba2+)=lgc(Ba2+),p(SO42)=lgc(SO42)。下列說法正確的是
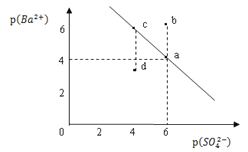
A. 該溫度下,Ksp(BaSO4)=1.0×1024
B. 加入BaCl2可以使溶液由c點變到a點
C. d點表示的是該溫度下BaSO4的不飽和溶液
D. a點的Ksp(BaSO4)小于b點的Ksp(BaSO4)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖像分別表示有關反應的反應過程與能量變化的關系。據此判斷下列說法正確的是
A. 石墨轉變為金剛石的反應是吸熱反應
B. 白磷比紅磷穩定
C. S(g)=S(s) ΔH>0
D. H2(g)+I2(g)![]() 2HI(g) ΔH>0
2HI(g) ΔH>0
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com