
(15分)【化學——選修2:化學與技術】
(一)硫酸廠常用煅燒黃鐵礦(FeS2)來制取硫酸。
(1)煅燒黃鐵礦的主要化學方程式為 。
(2)SO2和O2的反應為 2SO2(g)+O2(g) 2SO3(g),該反應在體積不變的密閉容器中進行,則下列 (填序號)可作為反應達到平衡的判斷依據。
2SO3(g),該反應在體積不變的密閉容器中進行,則下列 (填序號)可作為反應達到平衡的判斷依據。
A.v正(SO2)=v正(SO3)
B.各組分的體積分數不再變化
C.反應體系的溫度不再變化
D.混合氣體的平均相對分子質量不再變化
E.混合氣體的密度不再變化
(3)熱交換器是實現冷熱交換的裝置,化學實驗中也經常利用熱交換來實現某種實驗目的。試分析氣、液熱交換時通常使用的儀器是________________________。(寫名稱)
(4)硫酸工業所產生的尾氣除了含有N2、O2外,還含有SO2,微量的SO3和酸霧。能用于測定硫酸尾氣中SO2含量的試劑是___________________。(填序號)
A.NaOH溶液、酚酞試液 B.KMnO4溶液、稀硫酸
C. 氨水、酚酞試液 D.碘水、淀粉溶液
(二)實驗室常用硫酸廠的燒渣(主要成分是Fe2O3及少量FeS、SiO2)來制備綠礬(FeSO4·7H2O)。
其中測定綠礬產品中FeSO4·7H2O含量的實驗步驟為:
a.稱取5.2 g產品,溶解,配成250 mL溶液
b.量取25.00 ml待測液于錐形瓶中
c.用硫酸酸化的0. 01 mol/LKMnO4溶液滴定至終點,消耗KMnO4溶液體積35.00 mL。
據此,請分析:
(1)滴定時反應的離子方程式為(完成并配平離子反應方程式)。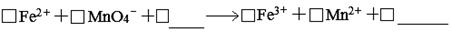
(2)滴定達到終點的標志是 。
(3)產品中FeSO4·7H2O的質量分數為 。
(除標注外,每空2分,共15分)
(一) (1) 4FeS2 + 11O2  2Fe2O3 + 8SO2 (2) B C D(少對一個扣1分,有錯計0分) (3) 冷凝管 (4)B D(對一個計1分,有錯計0分)
2Fe2O3 + 8SO2 (2) B C D(少對一個扣1分,有錯計0分) (3) 冷凝管 (4)B D(對一個計1分,有錯計0分)
(二)(1) 5 1 8H+ 5 1 4H2O (有錯計0分 )
(2) 滴加最后一滴高錳酸鉀溶液,溶液由無色變成淺紫色,且半分鐘不恢復原來顏色(合理答案均計分)
(3) 93.56% 或93.6%(3分)
解析試題分析:(一)(1)黃鐵礦的主要成分是FeS2 ,與氧氣反應生成二氧化硫、氧化鐵,化學方程式為4FeS2 + 11O2  2Fe2O3 + 8SO2 ;
2Fe2O3 + 8SO2 ;
(2)A、都表示正反應速率,錯誤;B、各組分的體積分數不再變化,說明反應已達平衡狀態,正確;C、該反應的熱效應不為0,所以無論是吸熱還是放熱反應,未達 平衡時溫度都在變化,當溫度不再變化時,說明已達平衡狀態,正確;D、該反應是氣體的物質的量發生改變的可逆反應,所以氣體的相對分子質量一直變化,當達到平衡時氣體的平均相對分子質量不再變化,正確;E、體積不變的容器中,根據質量守恒定律,氣體的密度一直不變,不能判斷平衡是否到達,錯誤,答案選BCD;
(3)化學實驗室中常用作熱交換的儀器是冷凝管;
(4)A、SO2,微量的SO3、酸霧都與氫氧化鈉溶液反應,所以無法測定二氧化硫的含量,錯誤;B、二氧化硫與酸性高錳酸鉀溶液反應,其余物質不反應,可以測定二氧化硫的含量,正確;C、氨水溶液顯堿性,與A的道理相同,不能測定二氧化硫的含量,錯誤;D、二氧化硫與碘反應,藍色溶液變為無色,其余物質不與碘反應,可以測定二氧化硫的含量,正確,答案選BD;
(二)(1)酸性高錳酸鉀溶液的氧化性更強,所以反應物的空白處應是H+,則產物的空白處應是H2O,根據得失電子守恒規律,Mn元素化合價降低5價,Fe元素化合價升高1價,所以Fe元素的系數是5,Mn元素的系數是1,再根據電荷守恒、觀察法配平其余物質的系數,答案是5 1 8H+ 5 1 4H2O;
(2)用酸性高錳酸鉀溶液滴定亞鐵離子,高錳酸鉀溶液為紫色,滴定達到終點時,滴加最后一滴高錳酸鉀溶液,溶液由無色變成淺紫色,且半分鐘不恢復原來顏色;
(3)消耗高錳酸鉀的物質的量為0.035L×0.01mol/L,則原溶液中Fe2+的物質的量為0.035L×0.01mol/L×5×10=0.0175mol,所以FeSO4·7H2O的質量是0.0175mol×278g/mol=4.865g,則產品中FeSO4·7H2O的質量分數為4.865g/5.2g×100%=93.56%.
考點:考查硫酸工業,反應原理,化學平衡狀態標志的判斷,氧化還原反應的計算


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:單選題
已知硫鐵礦在沸騰爐中煅燒,通入沸騰爐中的氣體原料是空氣,其中N2的體積分數為0.80,則沸騰爐排出的氣體中SO2的體積分數可能是
| A.0.13 | B.0.15 | C.0.22 | D.0.26 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
我國有豐富的天然氣資源。以天然氣為原料合成尿素的主要步驟如下圖所示(圖中某些轉化步驟及生成物未列出):
填寫下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸氣在t ℃,p k Pa時,完全反應生成一氧化碳和氫氣(合成氣),吸收了a kJ熱量,該反應的熱化學方程式是 。
(2)上述流程中,工業上分離H2 、CO2合理的方法是 。
A混合氣先通入氫氧化鈉溶液,再在溶液中加鹽酸
B混合氣加壓冷卻,使CO2液化
C混合氣用氨水洗滌
D混合氣先通入到石灰漿,然后高溫煅燒固體,
(3)為了保證氨氣順利合成,在空氣進入合成塔之前必須對空氣進行 ,目的是____________________;在合成氨的實際生產過程中,常采取將生成的氨從混合氣體中分離出來,分離出氨的方法 。
(4)合理地利用資源不僅可以提高經濟效益,而且也是對社會、對全人類負責的表現,闡述圖中的兩處可以合理利用資源情況 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
“低碳”既是時尚,也是環保要求。“低碳”在工業生產中意義重大,充分利用原材料,不排放或減少排放“三廢”,不同工廠聯合生產等都是很好的“低碳”生產方式。下面是幾個工廠利用廢氣、廢渣(液)聯合生產化肥硫酸銨的工藝:
請回答下列問題:
(1)工藝操作①、②分別為__________、__________。
(2)寫出生成“產品”的離子方程式_________________________________。
(3)檢驗合成氨廠廢氣中含有氨氣的方法是___________________________
___________________________________________________________。
(4)副產品的化學式為__________,該聯合生產工藝中可循環使用的物質是
________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
隨著世界糧食需求量的增加,農業對化學肥料的需求越來越大。氮肥是需求最大的一種化肥。氮肥的生產和合理施用在農業生產中起著重大作用。合成氨及化肥生產流程示意圖如下:
(1)目前,工業上用鐵觸媒作催化劑,在20~50 MPa、450℃左右用氮、氫混合氣體在________中進行合成氨。則沿X方向回去的物質是________。
(2)目前生產尿素是以氨氣與CO2為原料,發生反應的化學方程式是________、________。
尿素適用于各種土壤,在土壤中尿素發生水解,其水解的化學方程式是________。
(3)沉淀池中發生反應的化學方程式是________________。
(4)上述生產中的副產品氯化銨長期使用會造成土壤酸化、變硬甚至板結。對土壤的酸堿性進行測定與改良是保護________、提高土壤肥力的有效途徑。測定土壤的pH的方法是________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
空氣吹出法工藝,是目前“海水提溴”的最主要方法之一。其工藝流程如下:
(1)溴在周期表中位于________周期__________族。
(2)步驟①中用硫酸酸化可提高Cl2的利用率,理由是___________________________。
(3)步驟④利用了SO2的還原性,反應的離子方程式為__________________________。
(4)步驟⑥的蒸餾過程中,溫度應控制在80~90℃溫度過高或過低都不利于生產,請解釋原因____________________________________________________。
(5)步驟⑧中溴蒸氣冷凝后得到液溴與溴水的混合物,可利用它們的相對密度相差很大的特點進行分離。分離儀器的名稱是______________________________________。
(6)步驟①、②之后并未直接用“含Br2的海水”進行蒸餾得到液溴,而是經過“空氣吹出”、“SO2吸收”、“氧化”后再蒸餾,這樣操作的意義是_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
由美國通用原子能公司(GA)提出的碘硫循環被公認為是效率最高(預期轉化率可達50%以上)、最有希望實現的熱化學分解物質X的循環。其流程如下: 
(1)物質X是_____________(填化學式);在此循環過程中,有一種物質,當作為反應物時只是還原劑,作為生成物時是還原產物,該化合物是__________。
(2)在實驗室中進行蒸餾操作時,所需的玻璃儀器為蒸餾燒瓶、溫度計、尾接管、錐形瓶、____________。
(3)氧缺位鐵酸銅(CuFe2O4-x)可作上述流程中硫酸分解的催化劑。先在一定條件下,向Fe( NO3)3和Cu(NO3)2混合液中加入KOH,制得鐵酸銅( CuFe2O4),此反應的化學方程式為:____________;然后在______(填一常見氣體)保護下,高溫煅燒2h得到CuFe2O3.86,試計算1 mol CuFe2O3.86中Fe2+的物質的量為____mol。
(4)硫酸分解隨溫度等變化規律的實驗結果如圖所示,表示沒有使用催化劑的曲線是______(填圖中數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
某地農田土壤膠體的膠粒帶負電荷,若在該農田里施用含氮量相等的下列化肥,有效成分利用率最差的是 ( )。
| A.(NH4)2SO4 | B.NH4HCO3 |
| C.NH4NO3 | D.NH4Cl |
查看答案和解析>>
科目:高中化學 來源: 題型:單選題
下列有關工業生產的敘述正確的是( )
| A.合成氨生產過程中將NH3液化分離,可加快正反應速率,提高N2、H2的轉化率 |
| B.硫酸工業中,在接觸室安裝熱交換器是為了利用SO3轉化為H2SO4時放出的熱量 |
| C.電解飽和食鹽水制燒堿采用離子交換膜法,可防止陰極室產生的Cl2進入陽極室 |
| D.電解精煉銅時,同一時間內陽極溶解銅的質量比陰極析出銅的質量小 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com