
【題目】已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。一定條件下,向體積為1L的密閉容器中充入lmolCO2和3mo1H2,測得CO2和CH3OH(g)的濃度隨時間變化曲線如圖所示。下列敘述中正確的是
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。一定條件下,向體積為1L的密閉容器中充入lmolCO2和3mo1H2,測得CO2和CH3OH(g)的濃度隨時間變化曲線如圖所示。下列敘述中正確的是

A. 升高溫度平衡常數K增大
B. 反應達到平衡狀態時,CO2的平衡轉化率為75%
C. 3min時,用CO2的濃度表示的正反應速率等于用CH3OH的濃度表示的逆反應速率
D. 從反應開始到平衡,H2的平均反應速率v(H2)=0.075 mol·L-1·min-1
科目:高中化學 來源: 題型:
【題目】按要求完成填空。
(1)NaHCO3電離方程式:______________________________________________
(2)過氧化鈉與水反應的離子方程式:__________________________________________
(3)配平方程式:______NH4NO3![]() ______ HNO3 +_____ N2↑+______ H2O;在反應中被氧化與被還原的氮原子的個數比為________
______ HNO3 +_____ N2↑+______ H2O;在反應中被氧化與被還原的氮原子的個數比為________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】原子核外p能級、d能級等原子軌道上電子排布為“全空”“半滿”“全滿”的時候一般更加穩定,稱為洪特規則的特例。下列事實不能作為這個規則的證據的是( )
A.硼元素的第一電離能小于鈹元素的第一電離能
B.磷元素的第一電離能大于硫元素的第一電離能
C.基態銅原子的核外電子排布式為![]() 而不是
而不是![]()
D.某種激發態碳原子的核外電子排布式為![]() 而不是
而不是![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮硫的氧化物是造成大氣污染的主要物質。研究它們的反應機理,對于消除環境污染有重要意義。
(1)2NO(g)+O2(g)=2NO2(g)△H的反應機理和各基元反應(基元反應是指在反應中一步直接轉化為產物的反應,又稱為簡單反應)的活化能為:
2NO(g)![]() N2O2(g)E1=82kJ·mol-1v=k1c2(NO)
N2O2(g)E1=82kJ·mol-1v=k1c2(NO)
N2O2(g)![]() 2NO(g)E-1=205kJ·mol-1v=k-1c(N2O2)
2NO(g)E-1=205kJ·mol-1v=k-1c(N2O2)
N2O2(g)+O2(g)![]() 2NO2(g)E2=82kJ·mol-1v=k2c(N2O2)·c(O2)
2NO2(g)E2=82kJ·mol-1v=k2c(N2O2)·c(O2)
2NO2(g)![]() N2O2(g)+O2(g)E-2=72kJ·mol-1v=k-2c2(NO2)
N2O2(g)+O2(g)E-2=72kJ·mol-1v=k-2c2(NO2)
①2NO(g)+O2(g)![]() 2NO2(g)△H=______kJmol-1,平衡常數K與上述反應速率常數k1、k-1、k2、k-2的關系式為K=_______;
2NO2(g)△H=______kJmol-1,平衡常數K與上述反應速率常數k1、k-1、k2、k-2的關系式為K=_______;
②某溫度下反應2NO(g)+O2(g)![]() 2NO2(g)的速率常數k=8.8×10-2L2mol-2s-1,當反應物濃度都是0.05molL-1時,反應的速率是__________________molL-1s-1;若此時縮小容器的體積,使氣體壓強增大為原來的2倍,則反應速率增大為之前的______倍。
2NO2(g)的速率常數k=8.8×10-2L2mol-2s-1,當反應物濃度都是0.05molL-1時,反應的速率是__________________molL-1s-1;若此時縮小容器的體積,使氣體壓強增大為原來的2倍,則反應速率增大為之前的______倍。
(2)2SO2(g)+O2(g)![]() 2SO3(g)反應過程中能量變化如圖1所示。在V2O5存在時,該反應的機理為:V2O5+SO2
2SO3(g)反應過程中能量變化如圖1所示。在V2O5存在時,該反應的機理為:V2O5+SO2![]() 2VO2+SO3(快)4VO2+O2
2VO2+SO3(快)4VO2+O2![]() 2V2O5(慢)
2V2O5(慢)
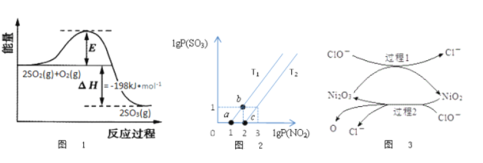
下列說法正確的是___________
A.反應速率主要取決于V2O5的質量
B.VO2是該反應的催化劑
C.逆反應的活化能大于198kJ/mol
D.增大SO2的濃度可顯著提高反應速率
(3)某研究小組研究T1℃、T2℃時,氮硫的氧化物的轉化:NO2(g)+SO2(g)![]() NO(g)+SO3(g)中lgP(NO2)和lgP(SO3)關系如圖2所示,實驗初始時體系中的P(NO2)和P(SO2)相等、P(NO)和P(SO3)相等。
NO(g)+SO3(g)中lgP(NO2)和lgP(SO3)關系如圖2所示,實驗初始時體系中的P(NO2)和P(SO2)相等、P(NO)和P(SO3)相等。
①根據題意可知:T1______T2(填“>”“<”或者“=”),理由是___________________。
②由平衡狀態a到b,改變的條件是__________________。
(4)工業上可用NaClO堿性溶液或“亞硫酸鹽法”吸收SO2。為了提高吸收效率,常用Ni2O3作為催化劑。催化過程如圖3所示。
①過程2的離子方程式_______________________________。
②Ca(C1O)2也可用于脫硫,且脫硫效果比NaC1O更好,原因是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2016年IUPAC命名117號元素為Ts(中文名“![]() ”,tián),Ts的原子核外最外層電子數是7。下列說法不正確的是
”,tián),Ts的原子核外最外層電子數是7。下列說法不正確的是
A.Ts是第七周期第ⅦA族元素
B.Ts的同位素原子具有相同的電子數
C.Ts在同族元素中非金屬性最弱
D.中子數為176的Ts核素符號是![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業制硝酸的主要反應為4NH3(g)+5O2(g)4NO(g)+6H2O(l)△H
(1)已知:氫氣的燃燒熱為285.8kJmol-1
N2(g)+3H2(g)2NH3(g)△H=-92.4kJmol-1
N2(g)+O2(g)2NO(g)△H=+180.6kJmol-1
則上述工業制硝酸的主要反應的△H=______。
(2)在容積固定的密閉容器中發生上述反應,容器內部分物質的物質的量濃度如下表:
濃度 | c(NH3)(molL-1) | c(O2)(molL-1) | c(NO)(molL-1) |
起始 | 0.8 | 1.6 | 0 |
第2min | 0.6 | a | 0.2 |
第4min | 0.3 | 0.975 | 0.5 |
第6min | 0.3 | 0.975 | 0.5 |
第8min | 0.7 | 1.475 | 0.1 |
①反應在第2min到第4min內,O2的平均反應速率為______。
②反應在第6min時改變了條件,改變的條件可能是______(填序號)。
A 使用催化劑 B 升高溫度C 減小壓強D 增加O2的濃度
③下列說法中能說明4NH3(g)+5O2(g)4NO(g)+6H2O(g)達到平衡狀態的是_____(填序號)。
A 單位時間內生成nmolNO的同時,生成nmolNH3
B 條件一定,混合氣體的平均相對分子質量不再變化
C 百分含量w(NH3)=w(NO)
D 反應速率v(NH3)∶v(O2) ∶v(NO) ∶v(H2O)=4∶5∶4∶6
E 若在恒溫恒壓下容積可變的容器中反應,混合氣體的密度不再變化
(3)某研究所組裝的CH3OH-O2燃料電池的工作原理如圖所示。
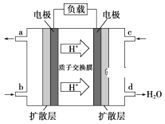
①該電池工作時,b口通入的物質為______。
②該電池正極的電極反應式為______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】把在空氣中久置的鋁片5.0 g投入盛有500 mL 0.5 mol/L硫酸溶液的燒杯中,該鋁片與硫酸反應產生氫氣的速率與反應時間的關系可用如圖所示的坐標曲線來表示,請回答下列問題:
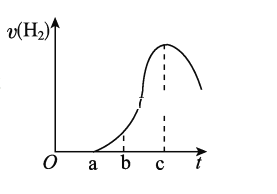
(1)曲線由O→a段不產生氫氣的原因是___________________________,有關的化學方程式為___________________________________________。
(2)曲線由a→c段,產生氫氣的速率增加較快的主要原因是_____________________。
(3)曲線由c以后,產生氫氣的速率逐漸下降的主要原因是_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一個體積為1 L的密閉容器中發生某化學反應:2A(g)![]() B(g)+C(g),三種不同條件下進行,其中實驗Ⅰ、Ⅱ都在800° C,實驗Ⅲ在950°C。B、C的起始濃度都為0,反應物A的濃度(mol L-1)隨時間(min)的變化如圖所示。試回答下列問題:
B(g)+C(g),三種不同條件下進行,其中實驗Ⅰ、Ⅱ都在800° C,實驗Ⅲ在950°C。B、C的起始濃度都為0,反應物A的濃度(mol L-1)隨時間(min)的變化如圖所示。試回答下列問題:

(1)在實驗Ⅰ中,反應在2040 min內A的平均反應速率為________mol L-1min-1。實驗Ⅱ和實驗Ⅰ相比,可能隱含的反應條件是____________。
(2)該反應的ΔH___________0,其判斷理由是_____________。
(3)實驗Ⅰ第40 min末,若降低反應溫度,達到新的平衡后,A的濃度不可能為________(填序號)。
A.0.35 mol·L1 B.0.4 mol·L1 C.0.7 mol·L1 D.0.8 mol·L1
(4)若反應在800°C進行,在該1 L的密閉容器中加入1 mol A、0.2 mol He,達到平衡時A的轉化率應____________。
A.等于86% B.等于50% C.小于50% D.在50%86%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】降低大氣中CO2的含量及有效地開發利用CO2,目前工業上有一種方法是用CO2來生產燃料甲醇。為探究反應原理,現進行如下實驗,在體積為1L的恒容密閉容器中,充入1mol CO2和3mol H2,一定條件下發生反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=-49.0kJ/mol。測得CO2和CH3OH(g)的濃度隨時間變化如圖所示。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol。測得CO2和CH3OH(g)的濃度隨時間變化如圖所示。
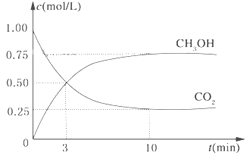
(1)從反應開始到平衡,氫氣的平均反應速率v(H2)=______mol/(Lmin);
(2)氫氣的轉化率=______;
(3)該反應的平衡常數為______(保留小數點后2位);
(4)下列措施中能使平衡體系中n(CH3OH)/n(CO2)增大的是______。
A.升高溫度 B.充入He(g),使體系壓強增大
C.將H2O(g)從體系中分離出去 D.再充入1mol H2
(5)當反應達到平衡時,H2的物質的量濃度為c1,然后向容器中再加入一定量H2,待反應再一次達到平衡后,H2的物質的量濃度為c2,則c1______c2的關系(填“>”、“<”或“=”)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com