
在一定條件下,在容積為2L的密閉容器中,將2mol氣體M和3mol氣體N混合,發生如下反應:2M(g)+ 3N(g)  x Q(g)+3R(g),經2min達平衡,生成2.4molR,并測得Q的濃度為0.4mol/L。求:
x Q(g)+3R(g),經2min達平衡,生成2.4molR,并測得Q的濃度為0.4mol/L。求:
(1)用氣體M來表示該反應的化學反應速率是多少?
(2)反應前后的壓強比?
(3)N的轉化率是多少?
(4)平衡時氣體Q所占的體積分數為多少?
2M(g) + 3N(g)  x Q(g)
+ 3R(g)
x Q(g)
+ 3R(g)
起始量(mol) 2 3 0 0
轉化量(mol) 1.6 2.4 0.8x 2.4
平衡量(mol) 0.4 0.6 0.8x 2.4
所以用氣體M來表示該反應的化學反應速率是
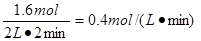
因為平衡時Q的濃度為0.4mol/L
所以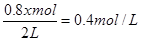 ,解得x=1
,解得x=1
因為壓強之比是相應的物質的量之比
所以反應前后的壓強比為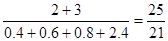
N的轉化率是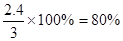
平衡時氣體Q所占的體積分數為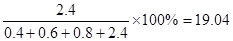
【解析】考查有關化學反應速率的計算。在有關反應速率的計算時一般采用三段式進行計算,即根據反應式分別列出起始量、轉化量和平衡量(或某時刻的量),然后在根據已知條件進行列式計算。


科目:高中化學 來源: 題型:閱讀理解
| 3 |
| 4 |
| 3 |
| 4 |
| 3 |
| 4 |
| 3 |
| 4 |
查看答案和解析>>
科目:高中化學 來源: 題型:

| A、加入適當催化劑,可以提高苯乙烯的產量 | B、在保持體積一定的條件下,充入較多的乙苯,可以提高乙苯的轉化率 | C、僅從平衡移動的角度分析,工業生產苯乙烯選擇恒壓條件優于恒容條件 | D、加入乙苯至反應達到平衡過程中,混合氣體的平均相對分子質量不斷增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、容器甲、丙中,逆反應的速率:v(甲)=v(丙) | B、容器甲、乙中,HI 的物質的量:n(甲)<n(乙) | C、容器甲、乙中有關反應物的轉化率:α(H2)+α(HI)<100% | D、容器甲、乙中,化學平衡常數:K(甲)=K(乙) |
查看答案和解析>>
科目:高中化學 來源:2013-2014學年上海市六校高三12月聯考化學試卷(解析版) 題型:填空題
氮氣及含氮的化合物在國民經濟中占有重要地位。合成氨工業中,合成塔中每產生2 mol NH3,放出92.4 kJ熱量。
(1)若起始時向容器內放入2 mol N2和6 mol H2,達平衡后放出的熱量為Q,則Q_____184.8kJ(填“>”、“<”或“=”) 。 一定條件下,在密閉恒容的容器中,能表示反應達到化學平衡狀態的是____________。
a.3v逆(N2)=v正(H2) b.2v正(H2)= v正(NH3)
c.混合氣體密度保持不變 d.c(N2):c(H2):c(NH3)=1:3:2
工業生產尿素的原理是以NH3和CO2為原料合成尿素[CO(NH2)2],反應的化學方程式為2NH3 (g)+ CO2 (g)  CO(NH2)2
(l) + H2O (l)。
CO(NH2)2
(l) + H2O (l)。
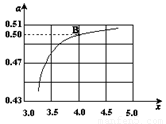
(2)在一定溫度和壓強下,若原料氣中的NH3和CO2的物質的量之比(氨碳比)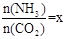 ,右圖是氨碳比(x)與CO2平衡轉化率(α)的關系。α隨著x增大而增大的原因是___________。
,右圖是氨碳比(x)與CO2平衡轉化率(α)的關系。α隨著x增大而增大的原因是___________。
(3)圖中的B點處,NH3的平衡轉化率為_______。
已知:3Cl2+2NH3→N2+6HCl ――① 3Cl2+8NH3→N2+6NH4Cl ――②
(4)完成并配平下列氧化還原反應方程式,再標出電子轉移的方向和數目:
12Cl2+15NH3→ ――③
(5)反應③中的還原劑是 ,還原產物是 。
(6)若按③反應后產生氣體9.408L(標準狀況),則被氧化的氣體的物質的量是 mol。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com