
【題目】在一定溫度下,固定體積為2L密閉容器中,發生反應:
2SO2(g)+O2(g)![]() 2SO3(g ) ΔH <0,n(SO2)隨時間的變化如表:
2SO3(g ) ΔH <0,n(SO2)隨時間的變化如表:
時間/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
則下列說法正確的是
A. 當v(SO2)=v(SO3)時,說明該反應已達到平衡狀態
B. 用O2表示0~4 min內該反應的平均速率為0.005 mol/(L·min)
C. 平衡時再通入O2,平衡右移,O2轉化率減小,SO2轉化率增大
D. 若升高溫度,則SO2的反應速率會變大,平衡常數K值會增大
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】X、Y、Z、W有如圖所示的轉化關系:
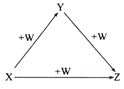
(1)若X單質的一種同素異形體是一種黑色的非金屬單質,則Y轉化為Z的化學方程式_____。
(2)若X為一種金屬的氯化物,Y是一種常見的兩性氫氧化物,W為化工常用的強堿,寫出Y與W反應的離子方程式_____________。
(3)若X是一種活潑的金屬單質,Z是一種淡黃色的化合物,則Z轉化為W的化學方程式_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究NO2、SO2 、CO等大氣污染氣體的處理具有重要意義。
(1)NO2可用水吸收,相應的化學反應方程式為______________________。利用反應6NO2+8NH3 ![]() 7N2+12 H2O也可處理NO2。當轉移1.2 mol電子時,消耗的NO2在標準狀況下是__________L。
7N2+12 H2O也可處理NO2。當轉移1.2 mol電子時,消耗的NO2在標準狀況下是__________L。
2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
則反應NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=_________kJ·mol、1。
SO3(g)+NO(g)的ΔH=_________kJ·mol、1。
一定條件下,將NO2與SO2以體積比1︰2置于密閉容器中發生上述反應,下列能說明反應達到平衡狀態的是
a.體系壓強保持不變
b.混合氣體顏色保持不變
c.SO3和NO的體積比保持不變
d.每消耗1 mol SO3的同時生成1 mol NO2
測得上述反應平衡時NO2與SO2體積比為1︰6,則平衡常數K=__________________。
(3)CO可用于合成甲醇,反應方程式為CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
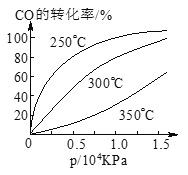
CO在不同溫度下的平衡轉化率與壓強的關系如圖所示。該反應ΔH___________0(填“>”或“ <”)。實際生產條件控制在250℃、1.3×104kPa左右,選擇此壓強的理由是________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有BaCl2和NaCl混合溶液aL,將它均分成兩份。一份滴加硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀.反應中消耗xmolH2SO4、ymolAgNO3.據此得知原混合溶液中的c(Na+)為
A. (2y-4x) /amol·L-1 B. (y-2x) /amol·L-1
C. (2y-2x) /amol·L-1 D. (y-x) /amol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】固體氧化物燃料電池是以固體氧化鋯—氧化釔為電解質,這種固體電解質在高溫下允許氧離子(O2-)在其間通過。該電池的工作原理如下圖所示,其中多孔電極a、b均不參與電極反應。
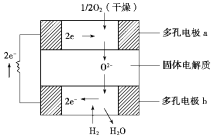
下列判斷正確的是( )
A.有O2參加反應的a極為電池的負極
B.正極極的電極反應式為H2-2e-+O2-===H2O
C.a極對應的電極反應式為O2+2H2O+4e-===4OH-
D.該電池的總反應式為2H2+O2![]() 2H2O
2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據磷元素的原子結構示意圖 ,做出如下推理,其中與事實不符的是
,做出如下推理,其中與事實不符的是
A. 磷元素位于元素周期表的第三周期、第ⅤA族
B. 磷原子不如氮原子和硫原子的得電子能力強
C. 磷單質不如氮氣和硫單質的化學性質活潑
D. 磷的氫化物(PH3)受熱時不如氮的氫化物(NH3)和硫的氫化物(H2S)穩定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【化學—選修5有機化學基礎】鄰苯二甲酸二乙酯![]() 是一種重要的工業塑化劑,其合成路線很多,下圖就是其中的一種合成方法:
是一種重要的工業塑化劑,其合成路線很多,下圖就是其中的一種合成方法:

已知以下信息:
① 有機化合物A可用來催熟水果。
② 有機化合物C的核磁共振氫譜顯示其有3種不同化學環境的氫原子。

(1)A的化學名稱是 ,B的結構簡式為 。
(2)反應Ⅱ的試劑是 ,該反應類型為 。
(3)C生成D的化學方程式為 。
(4)E生成F的化學方程式為 。
(5)在G的同分異構體中,既能與新制的Cu(OH)2懸濁液在加熱條件下反應生成磚紅色沉淀,又能與碳酸鈉反應生成二氧化碳,還能使FeCl3溶液顯色的有 種,所有這些同分異構體中,不同化學環境氫原子的種數 (填“相同”“不相同”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在半導體工業中,有一道工序叫燒氫。燒氫的工藝流程如圖所示。
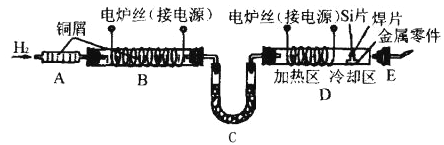
工作時,是將石英管D出口處氫氣點燃。半導體硅片、焊片和金屬零件從石英管口送入加熱區,在氫氣還原氣氛中加熱使焊片熔化,將單晶硅與金屬零件焊接在一起。焊接后再將零件拉至冷卻區,冷卻后取出。燒氫工藝中的氫氣純度要求極高,工業氫氣雖含氫量達99.9%,但仍含有極微量的水蒸氣和氧氣,所以點燃氫氣前應檢驗氫氣的純度。試回答下列問題:
(1)裝置B的作用是________;B中發生反應的化學方程式是________。
(2)裝置C中的物質是________;C的作用是________。
(3)點燃氫氣前將E(帶導管膠塞)接在D出口處,目的是________。
(4)裝置A是安全瓶,可以防止氫氣燃燒回火,引起爆炸,其中填充大量純銅屑的作用是________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com