
 H2S、金屬硫化物是硫的重要化合物.
H2S、金屬硫化物是硫的重要化合物.分析 (1)氣體壓強之比等于氣體物質的量之比,測得分解后得到H2和硫蒸汽,相同溫度下氣體壓強之比為2:3;
(2)①根據圖中各元素化合價變化分析;
②如圖轉化的關系分析可知,反應的化學方程式為CuS+2Fe3+=2Fe2++S+Cu2+,4Fe2++O2+4H+=4Fe3++2H2O,鐵離子相當于做催化劑作用,所以回收硫的總反應化學方程式為:2CuS+4H++O2=2Cu2++2S+2H2O;
③Fe2+轉化成Fe3+是氧氣氧化亞鐵離子為鐵離子;
(3)Sn2-和氫離子反應生成S單質,S元素失電子發生氧化反應,同時S元素得電子生成H2S.
解答 解:(1)氣體壓強之比等于氣體物質的量之比,測得分解后得到H2和硫蒸汽,相同溫度下氣體壓強之比為2:3,則依據物質的量之比和原子守恒寫出化學方程式為:2H2S$\frac{\underline{\;\;△\;\;}}{\;}$2H2+S2,氧化產物為S2,
故答案為:S2;
(2)①根據圖中各元素化合價知,Cu元素化合價都是+2價、H元素化合價都是+1價、Cl元素化合價都是-1價,所以化合價不變的是Cu、H、Cl元素,離子為
故答案為:Cu2+、Cl-;
②根據氧化還原反應中得失電子相等得,反應中當有1mol H2S轉化為硫單質時,保持溶液中Fe3+的物質的量不變,消耗O2的物質的量=$\frac{1}{2}$mol=0.5mol,如圖轉化的關系分析可知,反應的化學方程式為CuS+2Fe3+=2Fe2++S+Cu2+,4Fe2++O2+4H+=4Fe3++2H2O,鐵離子相當于做催化劑作用,所以回收硫的總反應化學方程式為:2CuS+4H++O2=2Cu2++2S+2H2O,
故答案為:2CuS+4H++O2=2Cu2++2S+2H2O;
③Fe2+轉化成Fe3+的離子方程式為:4Fe2++O2+4H+=4Fe3++2H2O,在工業生產中,適當提高混合氣體中空氣含量,其目的是增大氧氣的量使硫元素全部生成單質硫,保持鐵離子濃度不變,
故答案為:4Fe2++O2+4H+=4Fe3++2H2O,增大氧氣的量使硫元素全部生成單質硫;
(3)電解后陽極區離子為Sn2-,酸性條件下,Sn2-和氫離子反應生成S單質,S元素失電子發生氧化反應生成S單質,同時S元素得電子生成H2S,反應方程式為Sn2-+2H+=(n-1)S↓+H2S↑,
故答案為:H2S.
點評 本題考查了氧化還原反應的分析判斷,離子性質和元素化合價變化分析應用,掌握題干信息是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 過氧化鈉的電子式: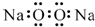 | B. | 次氯酸的結構式:H-Cl-O | ||
| C. | 硫原子的結構示意圖: | D. | NH4Cl的電子式: |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 離子或化合物 | Cr2O72- | Cr(OH)3 | Cr3+ | Cr°${\;}_{2}^{-}$ | CrO42- |
| 顏色 | 橙色 | 灰藍色 | 藍紫色 | 綠色 | 黃色 |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯制備硝基苯: | |
| B. | 用醋酸除去水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 乙醇通入熱的氧化銅中:CH3CH2OH+CuO$\stackrel{△}{→}$CH3CHO+Cu+H2O | |
| D. | 實驗室用液溴和苯在催化劑作用下制溴苯: |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 密度大小:硝基苯>水>苯 | |
| B. | 熔、沸點高低:乙醇>丁烷>丙烷 | |
| C. | 含碳量大小:乙烷>乙醇>乙酸 | |
| D. | 等質量燃燒時的耗氧量:乙烷>乙烯>丙烯 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
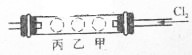 如圖所示,有一個硬質玻璃管兩端郡裝有帶導管的單孔塞,在試管中的右、中、左三個部位,分別放入浸有KI淀粉溶液的甲球、浸有NaI濃溶液的乙球和浸有KBr濃溶液的丙球.實驗時,從右端緩慢通人C12,同時在乙處微微加熱,并將熱源從乙向丙處慢慢移動,觀察到的現象是:
如圖所示,有一個硬質玻璃管兩端郡裝有帶導管的單孔塞,在試管中的右、中、左三個部位,分別放入浸有KI淀粉溶液的甲球、浸有NaI濃溶液的乙球和浸有KBr濃溶液的丙球.實驗時,從右端緩慢通人C12,同時在乙處微微加熱,并將熱源從乙向丙處慢慢移動,觀察到的現象是:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com