
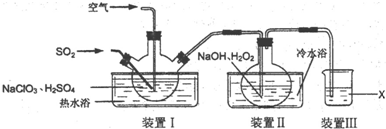
分析 根據實驗裝置圖,裝置Ⅰ中用二氧化硫還原氯酸鈉生成二氧化氯,裝置Ⅱ中用雙氧水在堿性條件下還原二氧化氯生成NaClO2,裝置Ⅲ中用氫氧化鈉吸收尾氣,以防止污染空氣,
(1)裝置Ⅱ中反應生成NaClO2,反應結束后通入適量的空氣,將ClO2吹入到裝置Ⅱ進行反應;
(2)裝置Ⅱ中反應生成NaClO2,Cl元素的化合價降低,雙氧水應表現還原性,有氧氣生成,結合原子守恒可知,還有水生成,配平書寫方程式;
裝置I中通入SO2的不完全反應,在裝置Ⅱ中被氧化生成硫酸,可以用利用硫酸鋇是白色沉淀檢驗硫酸根;
(3)從溶液中制取晶體,一般采用蒸發結晶、過濾、洗滌、干燥的方法,注意溫度控制;
(4)裝置Ⅲ中的作用是吸收尾氣中可能存在的二氧化硫、ClO2等,防止污染空氣,可以用氫氧化鈉溶液吸收;
解答 解:(1)裝置Ⅱ中反應生成NaClO2,反應結束后通入適量的空氣,將ClO2吹入到裝置Ⅱ進行反應,
故答案為:將ClO2吹入到裝置Ⅱ進行反應;
(2)裝置Ⅱ中反應生成NaClO2,Cl元素的化合價降低,雙氧水應表現還原性,有氧氣生成,結合原子守恒可知,還有水生成,配平后方程式為:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;裝置I中通入SO2的不完全反應,在裝置Ⅱ中被氧化生成硫酸,溶液中可能存在SO42-;可以用氯化鋇溶液檢驗SO42-,具體操作:取少量反應后的溶液,先加足量的鹽酸,再加BaCl2溶液,若產生白色沉淀,則說明含有SO42-,
故答案為:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;SO42-;取少量反應后的溶液,先加足量的鹽酸,再加BaCl2溶液,若產生白色沉淀,則說明含有SO42-;
(3)從溶液中制取晶體,一般采用蒸發結晶、過濾、洗滌、干燥的方法,為防止析出晶體NaClO2•3H2O,應趁熱過濾,由題目信息可知,應控制溫度38℃~60℃進行洗滌,低于60℃干燥,
故答案為:趁熱過濾;用38℃~60℃熱水洗滌;低于60℃干燥;
(4)裝置Ⅲ中的作用是吸收尾氣中可能存在的二氧化硫、ClO2等,可以用氫氧化鈉溶液吸收,防止污染空氣,
故答案為:NaOH溶液.
點評 本題考查物質的制備、對信息的利用、對裝置的理解等,理解原理是解題的關鍵,同時考查學生分析問題、解決問題的能力,難度較大.


科目:高中化學 來源: 題型:實驗題
| 加熱前質量 | 加熱后質量 | ||
| m1 | m2 | m3 | m4 |
| 5.400g | 7.900g | 6.900g | 6.901g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 僅能表示化學反應中伴隨放出熱量多少的化學方程式 | |
| B. | 能夠表示化學反應中熱效應的化學方程式 | |
| C. | 熱效應的大小與反應的溫度、壓強無關,只與反應物和生成物的狀態有關 | |
| D. | 當多步反應中熱化學方程式相加時,相對應的熱量要相減 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 升高溫度,正向反應速率減小,逆向反應速率增大 | |
| B. | 升高溫度有利于正、逆反應速率增大,從而縮短達到平衡的時間 | |
| C. | 達到平衡后,升高溫度或增大壓強都有利于該反應平衡逆向移動 | |
| D. | 達到平衡后,降低溫度或減小壓強都有利于該反應平衡正向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 時間/min | 5 | 10 | 15 | 20 | 25 | 30 |
| C(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com